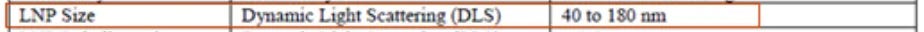📅 17.02.2026 · Originalartikel lesen →
LNP sind streng genommen Nanomedizin. Was wäre, wenn man statt sich über die Definition, ob es nun Impfstoffe sind oder nicht zu streiten einfach klein beigibt und sagt, OK dann lasst es halt Impfstoffe sein ABER sie fallen unter die Regeln für Nanomedizin?
Dazu gibt es tatsächlich einen wissenschaftlichen Artikel aus dem Jahr 2023.
Musazzi UM, Franzè S, Condorelli F, Minghetti P, Caliceti P. Feeding Next-Generation Nanomedicines to Europe: Regulatory and Quality Challenges. Adv Healthc Mater. 2023 Dec;12(30):e2301956. doi: 10.1002/adhm.202301956. Epub 2023 Sep 17. PMID: 37718353; PMCID: PMC11468706. https://pmc.ncbi.nlm.nih.gov/articles/PMC11468706/
Man vermeidet es in diesem Artikel tunlichst auszusprechen, dass die modRNA-LNPs unter diese Regeln fallen, aber spricht alle Probleme an.
Ich reduziere den Artikel auf die Highlights. Der Artikel ist open acceess, jeder kann ich komplett lesen.
Der Abstract spoilert eigentlich bereits den ganzen Artikel. Der Spannungsbogen ist damit direkt hinüber.
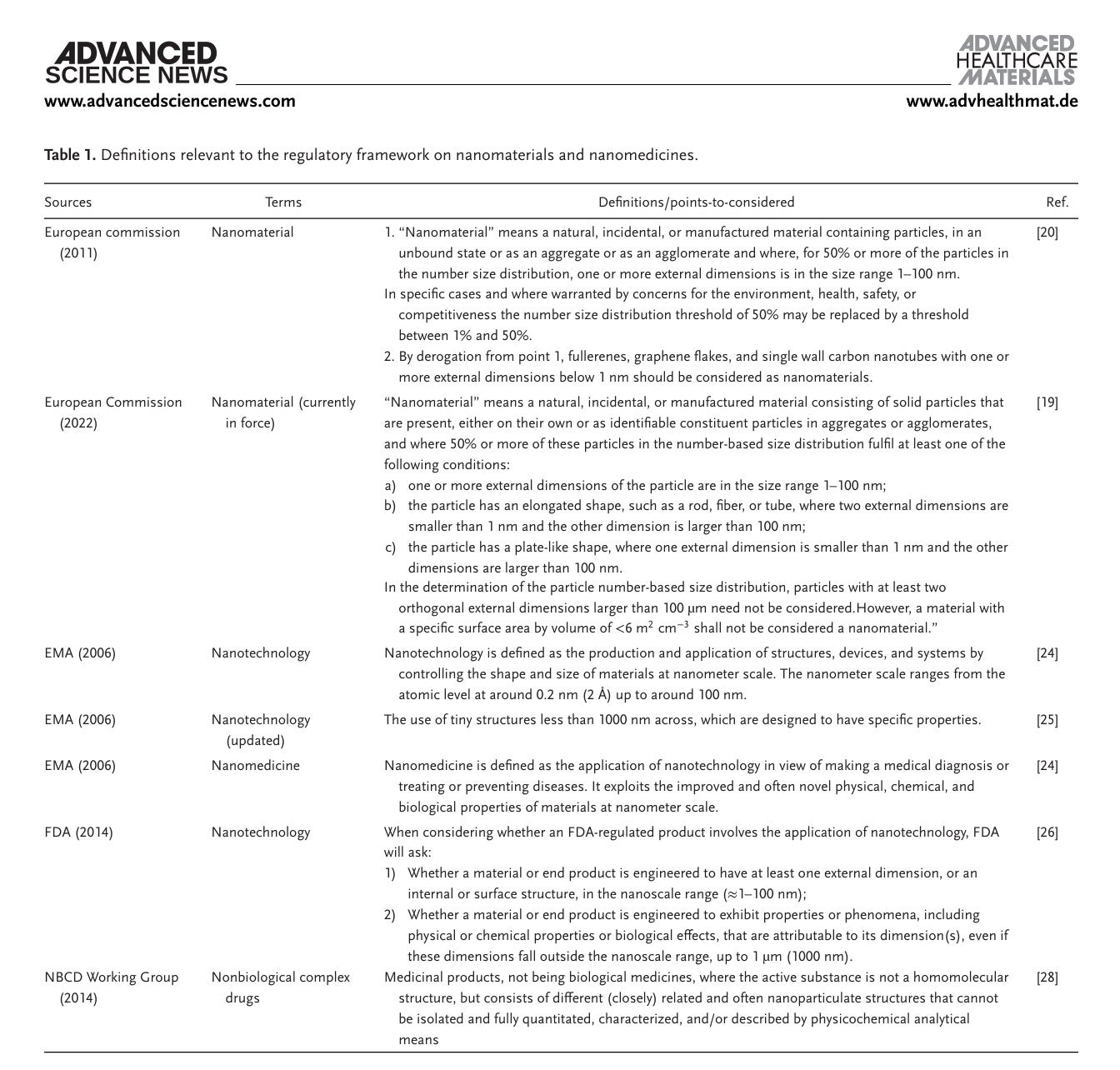
Obwohl weltweit noch keine einheitliche regulatorische Definition vorliegt, bezeichnet der Begriff „Nanomedikamente“ im Allgemeinen Arzneimittel, bei deren Entwicklung oder Herstellung Nanotechnologie zum Einsatz kommt.
Wir stehen also wieder vor dem altbekannten Problem der Definition. Wenn etwas nicht genau definiert ist, ist Manipulation Tür und Tor geöffnet, wie z. Bsp. bei der Definition einer Pandemie. Je windelweicher und je vielfältiger die Definitionen, desto einfacher die Manipulation. Man muss nun juristisch darauf drängen, dass schnellstens eine weltweit verbindliche Definition her muss.
Im Gegensatz zu herkömmlichen Formulierungen (z. B. Tabletten, Sirups), die so konzipiert sind, dass sie die Wirkstoffladung vor dem Passieren der Biomembranen freisetzen und die Transportmechanismen nicht beeinflussen, spielen nanomedizinische Produkte eine entscheidende Rolle beim Transport von Wirkstoffen durch die Körperkompartimente und bestimmen deren Schicksal. Daher werden ihre Absorption, Verteilung, ihr Metabolismus, ihre Ausscheidung und ihr Toxizitätsprofil eher durch das Nanosystem als durch den Wirkstoff selbst bestimmt. Dies ist auf die besonderen physikalisch-chemischen Eigenschaften dieser Systeme zurückzuführen, deren Leistung stark von ihren physikalisch-chemischen Eigenschaften (z. B. Größe, Polydispersität, Form, Architektur, Dichte, Oberflächenmerkmale) und weniger von den allgemeinen Masseeigenschaften bestimmt wird.
Und die Lipidnanotechnologie fällt leider auch darunter. Das ist mit eine Erklärung dafür, dass einige Chargen toxischer waren als andere.
Folglich können Nanosysteme, wenn sie in den Körper eingebracht werden, unabhängig von ihrem medizinischen Zweck toxikologische Risiken mit sich bringen, die mit einer unbekannten, unvorhersehbaren oder unerwünschten Verteilung in Geweben und Wechselwirkungen mit biologischen Bestandteilen verbunden sind.
Wirklich? Was Du nicht sagst Sherlock! Ich denke, das haben wir in den letzten Jahren im weltweiten Großversuch beobachten können.
Hat man sich daher vielleicht die toxikologischen Studien lieber gespart, weil man keine Lust hatte “unbekannte, unvorhersehbare oder unerwünschte Verteilungen in Geweben und Wechselwirkungen mit biologischen Bestandteilen” zu finden?
“Die Toxizität der LNP-Formulierung oder der neuartigen Hilfsstoffe allein wurde nicht speziell untersucht.”
Da geringfügige Unterschiede in den physikalisch-chemischen Eigenschaften der Rohstoffe oder Herstellungsverfahren einen starken Einfluss auf das Qualitätsprofil und das In-vivo-Verhalten von Nanomedikamenten haben können, ist es trotz der Erfahrungen mit herkömmlichen Arzneimitteln komplexer, ihr Schicksal sowie ihre toxikologischen oder therapeutischen Wirkungen vorherzusagen. Dementsprechend wurden Nanomedikamente auf regulatorischer Ebene in die breite Klasse der nicht-biologischen komplexen Arzneimittel (NBCDs) aufgenommen, zusammen mit anderen Produkten, die eine hohe intrinsische Komplexität, supramolekulare Strukturen und Zusammensetzungen aufweisen, die eine vollständige physikalisch-chemische Charakterisierung nicht zulassen.
“Da geringfügige Unterschiede in den physikalisch-chemischen Eigenschaften der Rohstoffe oder Herstellungsverfahren einen starken Einfluss auf das Qualitätsprofil und das In-vivo-Verhalten von Nanomedikamenten haben können.”
Diesen Satz sollte man sich auf der Zunge zergehen lassen.
“Da geringfügige Unterschiede in den physikalisch-chemischen Eigenschaften der Rohstoffe oder Herstellungsverfahren einen starken Einfluss auf das Qualitätsprofil und das In-vivo-Verhalten von Nanomedikamenten haben können.”
Drei Lieferanten für die Lipide, teilweise unbekannte Verunreinigungen , die von Lieferant zu Lieferant variieren, Einsatz von Razematen und SEHR weit gesteckte Grenzwerte. Was kann da schon passieren, wenn schon “geringfügige Unterschiede in den physikalisch-chemischen Eigenschaften der Rohstoffe oder Herstellungsverfahren einen starken Einfluss auf das Qualitätsprofil und das In-vivo-Verhalten von Nanomedikamenten haben können.”
Wie man an den Fußnoten zu alten Artikeln sieht, habe ich das Thema schon detailliert bearbeitet. Aber es ist schön, so einen Satz in einem wissenschaftlichen Artikel zu lesen.
Wenn man also modRNA-LNPs als Nanomedizin behandelt hätte, hätte man auf diese Probleme geachtet, vermute ich.
Sowohl die Europäische Arzneimittelagentur (EMA) als auch die US-amerikanische Food and Drug Administration (FDA) haben mehrere Leitlinien und Reflexionspapiere veröffentlicht, um die Akteure der pharmazeutischen Industrie bei der ordnungsgemäßen Bewertung der Qualität, Wirksamkeit und Sicherheitsprofile solcher Produkte zu unterstützen.
Vielleicht sollten sich Anwälte diese Papiere näher ansehen. Das könnte eine Möglichkeit sein BioNTech/Pfizer und Moderna bei den Eier zu packen. Weg von der juristisch vergifteten Impfstoff/Gentherapie Diskussion hin zu einer Nanomedizin Diskussion. Dann ist die BioNTech/Pfizer und Moderna Plörre eben eine nanomedizinische “Impfung”. Wenn es juristisch hilft, sie ans Kreuz zu schlagen, warum nicht?
Um den ersten Schritt zur Erfüllung der festgelegten regulatorischen Anforderungen für Nanopharmazeutika zu tun, wurden mehrere neue Methoden, Techniken und Analyseprotokolle entwickelt, um die nanoskalige Beschaffenheit von Nanomaterialien und Nanomedikamenten zu charakterisieren.
Ich gehe davon aus, dass diese “Methoden, Techniken und Analysemethoden” bei dem modRNA-Produkten nicht zum Einsatz kamen. Das müsste man sich gegebenenfalls genauer anschauen.
Daher ist eines der kritischen Themen im Zulassungsverfahren für Nanomedikamente die weit gefasste Definition von nanotechnologischen Systemen (d. h. Nanosystemen) für medizinische Zwecke, die die strukturellen und physikalisch-chemischen Eigenschaften dieser Produkte hinsichtlich ihrer Verwendung und ihres Verbleibs identifiziert. Das Fehlen eines Konsenses über die Definition von Nanomedikamenten hat zu einer Vielzahl von Begriffen geführt, die zur Bezeichnung verwandter Produkte verwendet werden (z. B. Nanomaterialien, Nanomedikamente, Nanopharmazeutika, Nanopartikel und Nanosysteme), was die regulatorische Unsicherheit in diesem Bereich noch verstärkt hat.
Hier sind wie im zu Eingangs erwähnten Problem der Definition. Wenn man nicht genau definieren kann, muss man eben aufzählen, was definitiv unter Nanomedikamente subsummiert wird, damit die Hersteller derartiger Produkte sich nicht rauswinden können.
Tabelle 1 fasst die verschiedenen Definitionen und Regularien verschiedener Jurisdiktionen zusammen:
In Europa haben EMA und die Europäische Kommission eigene Definitionen? Welche zählt jeweils? Können die sich nicht mal intern einigen? Zum Zeitpunkt des Erscheinens des Artikels scheinen die Regel von Fußnote 19 gegolten zu haben. Ob die immer noch gelten müssten sich Juristen bei Bedarf genauer anschauen.
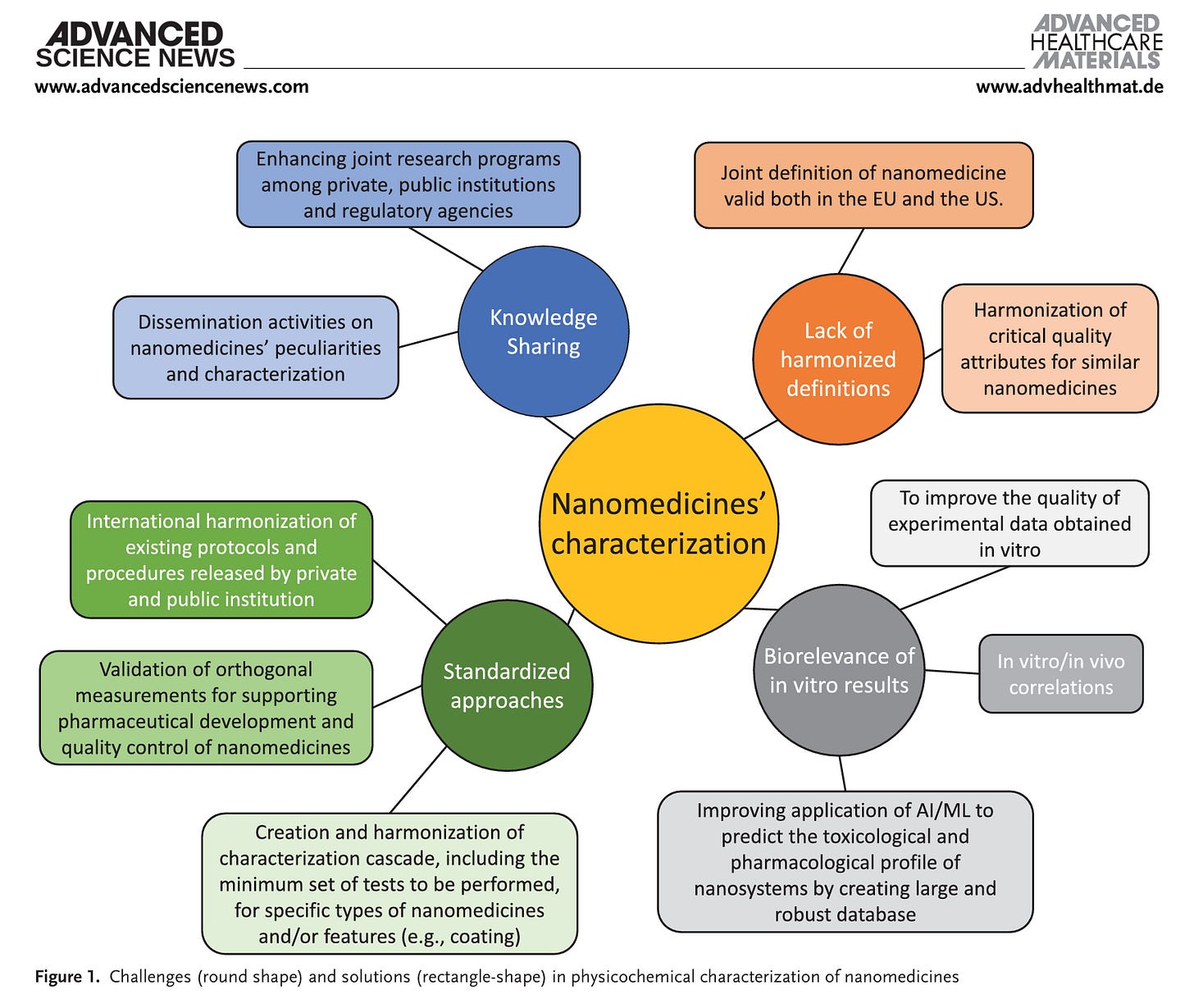
Herausforderungen (runde Form) und Lösungen (rechteckige Form) bei der physikalisch-chemischen Charakterisierung von Nanomedikamenten:
Die überarbeitete Fassung stellt klar, dass in der Europäischen Union die Verwendung des Begriffs „Nanomaterial“ auf feste Stoffe beschränkt sein sollte, die mindestens eine der in der Definition aufgeführten Bedingungen erfüllen. Einzelne Moleküle werden von der Europäischen Kommission nicht als Partikel betrachtet. Daher sind nicht feste Strukturen und Makromoleküle ausdrücklich von der Definition ausgenommen.
Da kann ich der EU sogar einmal zustimmen, wer hätte das gedacht.
Umgekehrt sind Liposomen, Mizellarsysteme, proteinbasierte Nanopartikel und andere Nanosysteme, die für die Abgabe und/oder gezielte Zuführung von Wirkstoffen an Lebewesen entwickelt wurden, gemäß der Definition der Europäischen Kommission keine Nanomaterialien.
Und hier liegt der Hund begraben. DAS ist grenzwertig. Andererseits würden darunter bereits liposomale Nahrungsergänzungsmittel fallen.
Wie von der EMA und der FDA hervorgehoben, decken Nanomedikamente interdisziplinäre Bereiche ab und erfordern daher einen multidisziplinären Ansatz und eine multidisziplinäre Bewertung. Wie bereits in der Einleitung erwähnt, werden auf regulatorischer Ebene alle Nanomedikamente traditionell in die breitere Klasse der NBCDs (Nano-Biopharmazeutika) eingeordnet, wie sie von der NBCD-Arbeitsgruppe definiert wurde (Tabelle 1). Dies erscheint richtig, obwohl die intrinsische Komplexität der meisten Nanomedikamente auf den Nanoträger und nicht auf den Wirkstoff selbst zurückzuführen ist.
Auch auf die Gefahr hin mich zu wiederholen: Daher hat man den Nanoträger im Falle der modRNA-LNP NICHT charakterisiert.
Selbst wenn die Plasmakonzentrationsprofile überlagerbar sind, können die Wechselwirkungen und Wirkungen von Nanomedikamenten mit Plasmaproteinen und anderen menschlichen Bestandteilen unterschiedlich sein, was sich auf die Clearance, die Wirksamkeit und die Toxizitätsprofile auswirken kann.
Ich hatte dazu gerade einen Artikel zu einem Preprint. Das lästige Problem mit der Proteinkorona hat man in der Zulassung der modRNA-LNPs lieber erst gar nicht gegenüber den regulierenden Behörden erwähnt. Diese lästigen Fragen wollte man sich sicherlich lieber sparen. Das hätte zu viele Sicherheitsstudien nach sich gezogen, das wollte man wohl vermeiden.
Folglich sollte die Bewertung des Nutzen-Risiko-Verhältnisses von NBCDs und Nanomedizinprodukten durch zusätzliche Vergleichbarkeitsstudien untermauert werden, die die Ähnlichkeit/Gleichwertigkeit der beiden Produkte in Bezug auf Qualität, Wirksamkeit und Sicherheitsmuster nachweisen können.
Meinen die Autoren damit
Verfahrensänderungen wie Prozess 1 gegenüber Prozess 2?
verschiedene Lieferanten?
Unterschiedliche Firmen, welche die Formulierung machen wie Allergopharma und Dermapharm gegenüber Polymum? Könnte es sein, dass Kremchenhersteller andere Ausrüstung verwenden als die Firma, welche die Studienmedikation formuliert hat? Hat man das verglichen?
Pufferwechsel von Phosphatpuffer zu Tris?
Im Falle der Nanomedizin spielen die Nanosysteme die Hauptrolle bei der Bestimmung des Verbleibs des Arzneimittels, da sie an allen Wechselwirkungen mit Biostrukturen, einschließlich Proteinen und Zellen, sowie an der Biodistribution und Akkumulation in Geweben und Organen beteiligt sind, während im Falle traditioneller pharmazeutischer Produkte die Formulierung die Bioverfügbarkeit beeinflusst, indem sie die Freisetzung des Arzneimittels bestimmt. Daher kann die Bewertung der Bioverfügbarkeit durch die Beurteilung des Arzneimittelprofils im Blut bei nanotechnologischen und traditionellen Formulierungen nicht identisch sein. In diesem Zusammenhang haben sowohl die FDA als auch die EMA Leitlinien zu bestimmten Arten von Nanomedikamenten (z. B. Liposomen, Eisenkernpartikel und Blockcopolymer-Mizellen) veröffentlicht, um festzulegen, welche zusätzlichen Daten zur Charakterisierung von First-in-Human-Produkten oder zum Vergleich von Folgeprodukten bereitgestellt werden sollten.
Wenn es diese Leitlinien gibt, warum wurden diese dann nicht auf die modRNA-LNP Produkte angewendet? Das würde sich der Definition als Impfstoff nicht widersprechen.
In dieser Hinsicht erscheint es angemessen, therapeutisch gleichwertige Kopien von Nanomedizinprodukten nach Regulierungsgrundsätzen zu bewerten, die eher denen für die Zulassung von Biosimilars als denen für Generika entsprechen.
Ich glaube mich aus meiner Zeit bei Almirall zu erinnern, dass man bei Biosimilars noch mal eine komplette neue Studie durchführen muss. Gälte das auch schon bei Pufferwechsel?
Die physikalisch-chemischen Eigenschaften eines Nanosystems bestimmen maßgeblich dessen Verhalten in vivo. Tatsächlich erfolgt die „Wechselwirkung“ zwischen Nanosystemen und biologischen Strukturen, darunter zirkulierende Makromoleküle, Zellen und Gewebe, über Oberflächeninteraktionen.
Zum Beispiel durch eine Proteinkorona, die man weder untersucht noch gegenüber der FDA oder EMA auch nur erwähnt hat.
Das Verhältnis von Oberfläche zu Größe bei 3D-Systemen ergibt sich aus dem Zusammenspiel von Größe, Morphologie und Oberflächenzusammensetzung. Das Verhältnis von Oberfläche zu Volumen bei 3D-Systemen nimmt mit abnehmender Größe zu, während das Verhältnis von Oberfläche zu Volumen von der Morphologie abhängt und bei Kugeln einen Minimalwert aufweist. Daher sollten drei Parameter als relevant für die Beschreibung der physikalisch-chemischen Eigenschaften von Nanosystemen angesehen werden:
a) Partikelgröße und Polydispersität,
b) Morphologie und
c) Oberflächenzusammensetzung.
Partikelgröße:
Die Morphologie wurde von unabhängigen Wissenschaftlern erst geklärt, als das Produkt schon Jahre auf dem Markt war.
Die Oberflächenzusammensetzung = Corona ist bisher noch unbekannt.
Die Partikelgröße ist das Hauptmerkmal, das Nanosysteme identifiziert und ihr Verhalten in vitro und in vivo bestimmt. Sie beeinflusst die Stabilität sowohl in Dispersionen als auch in physiologischen Flüssigkeiten, die Penetration durch Gewebe (einschließlich Haut und Schleimhäute), die Biodistribution und die Elimination und damit auch das pharmakokinetische (PK) Profil.
Pharmakokinetik, da war doch was? Genau! Die wurden nicht untersucht!
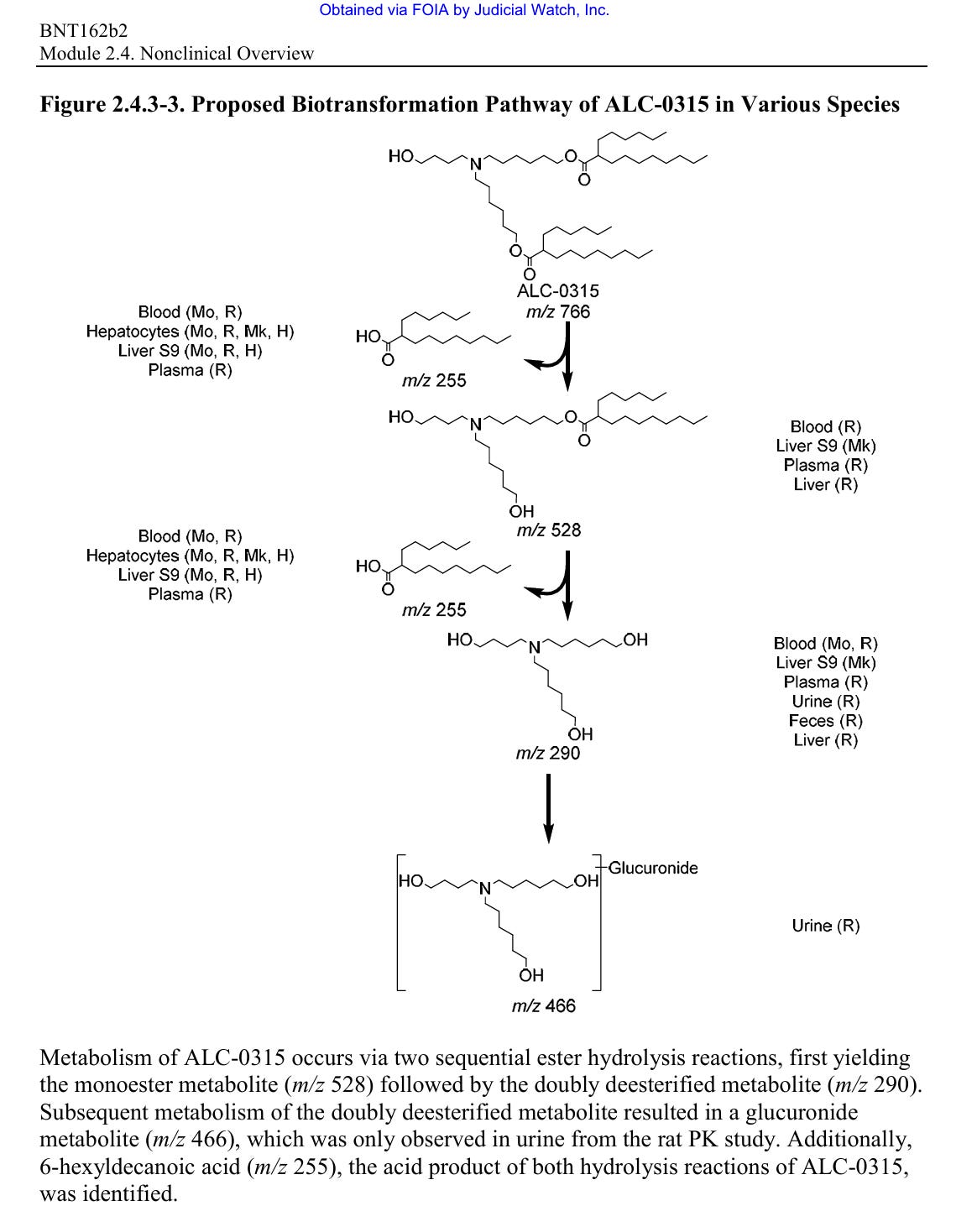
Zur Elimination gibt es eine zumindest Hypothese in Form eines vorgeschlagenen Abbauweges für zumindest eines der Lipide.
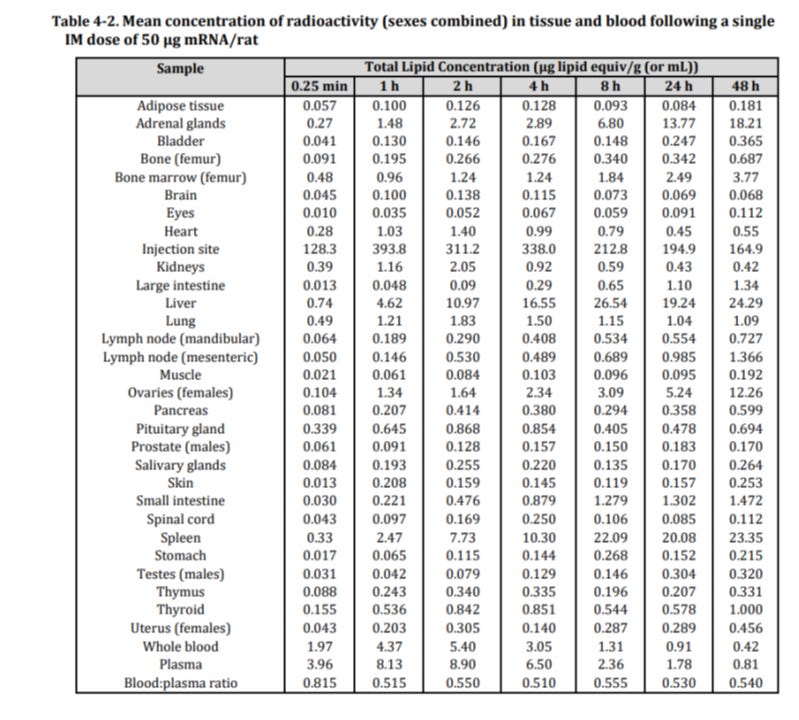
Biodistribution? Geht überall hin. Unkontrolliert.
“Penetration durch Gewebe (einschließlich Haut und Schleimhäute)” ist damit auch Shedding gemeint? Mir liegen zu Haut- oder Schleimhautpenetration keinerlei Daten vor. Ist so was wichtig?
Bei intravenöser Verabreichung (mit Ausnahme von Nanokristallen sind die meisten anderen im Handel erhältlichen Nanomedizinprodukte für die parenterale Verabreichung zugelassen) hängt das Schicksal eines Nanosystems in erster Linie von der Wechselwirkung mit den Blutproteinen ab, die die sogenannte Proteinkorona bilden. Bemerkenswert ist, dass die Bildung einer solchen Proteinkorona die Gesamteigenschaften von Nanosystemen drastisch verändern kann. Um sich weiter in Organen und Geweben zu verteilen, müssen Nanosysteme dem Immunsystem entkommen.
Das Thema Proteinkorona habe ich in diesem Text schon mehrfach behandelt. Aber der Satz “ Bemerkenswert ist, dass die Bildung einer solchen Proteinkorona die Gesamteigenschaften von Nanosystemen drastisch verändern kann.” zeigt noch einmal wie wichtig es für die Firmen war, das Thema nicht anzusprechen. Zu diesem Zeitpunkt konnte man die Proteinkorona auf LNPs wohl noch nicht messen und bestimmen, wenn es dazu erst im Dezember 2025 ein erstes Preprint gab.
Der Weg der Ausscheidung hängt vom Durchmesser eines Nanosystems ab: Systeme mit einer Größe von weniger als 10 nm werden durch renale Ultrafiltration ausgeschieden, während alle größeren Strukturen von Makrophagen in Leber und Milz phagozytiert und durch das retikuloendotheliale System (RES) eliminiert werden. Je größer das System, desto effizienter ist dieser Eliminierungsprozess; Nanosysteme mit einem durchschnittlichen Durchmesser von 80 bis 100 nm weisen die niedrigste RES-Makrophagen-Aufnahmerate auf. In einer Arbeit, in der die Biodistribution von nicht-PEGylierten Liposomen unterschiedlicher Größe (30–400 nm) verglichen wurde, wurde gezeigt, dass Liposomen, die kleiner als 50 nm und größer als 250 nm sind, stattdessen größtenteils aus dem Kreislauf ausgeschieden werden.
Die LNP sind zwischen 40 bis 180 nm. Genau der Bereich, der NICHT einfach eliminiert wird.
Neben der Partikelgröße hat auch die Morphologie einen erheblichen Einfluss auf die klinische Wirksamkeit und Sicherheit von Nanosystemen. Einerseits bestimmen die morphologischen Eigenschaften der Oberfläche den biologisch „aktiven“ Bereich der Partikel. Andererseits beeinflussen die Oberflächeneigenschaften die Bewegung der Partikel durch biologische Gewebe und Strukturen, einschließlich der Zirkulation im Blutkreislauf, der Gewebepenetration und der zellulären Aufnahme.
Und all das war vor Freigabe durch die Behörden NICHT geklärt.
Die Oberflächeneigenschaften sind wiederum maßgeblich für das biologische Verhalten von Nanosystemen in vivo verantwortlich. Sie werden direkt von der Zusammensetzung der Oberfläche und indirekt von der Partikelgröße und -form bestimmt. Die Oberflächenladung, das Gleichgewicht zwischen hydrophilen und hydrophoben Eigenschaften sowie spezifische Targeting- oder Beschichtungsgruppen (z. B. Polyethylenglykol, PEG) auf der Oberfläche des Nanosystems führen zu einer unspezifischen oder spezifischen Wechselwirkung mit biologischen Komponenten wie Schleimschichten auf Schleimhäuten, zirkulierenden Proteinen und Zellen. Auch hier werden die Oberflächeneigenschaften stark von der Proteinkorona beeinflusst, da absorbierte Proteine und Makromoleküle zu neuen und unterschiedlichen physikalischen Eigenschaften führen können. Dieser Prozess ist äußerst komplex und noch nicht vollständig verstanden.
Wie genau will man das Risiko für etwas bestimmen und abschätzen, das noch nicht vollständig verstanden und zum Zeitpunkt der Zulassung nicht geklärt war (und heute noch nicht geklärt ist)?
Das Aufpfropfen von PEG auf die Oberfläche eines Nanosystems ist jedoch eine bekannte Formulierungsstrategie, um die Proteinbindung zu verhindern und dadurch die Blutzirkulation zu verlängern.
Wenn das bereits mehrfach erwähnte Preprint recht hat, dann hat PEG KEINEN EINFLUSS AUF DIE PROTEINKORONA sondern des Phospholipid bestimmt die Proteinkorona.
Andererseits erhöht die Entwicklung von dekorierten Nanosystemen für aktives Targeting oder Impfstoffe die Komplexität der Herstellungs- und Qualitätskontrollverfahren.
Welche Kontrollverfahren? Gab es da etwas bei der Zulassung der modRNA-LNPs, was ich nicht mitbekommen habe?
Tatsächlich verlangten die wichtigsten Aufsichtsbehörden eine gründliche Untersuchung der chemischen Konjugation der Ziel-/Antigen-Einheiten auf der Oberfläche des Nanomedikaments sowie eine Untersuchung seiner Konformation, die wiederum die Interaktion mit den Rezeptoren beeinflusst. Hinzu kommt, dass Oberflächenmodifikationen eines Nanosystems zu Veränderungen seines toxikologischen Profils führen können.
Oh, wirklich? Warum wurde das dann nicht gemacht?
Die Charakterisierung der Partikelgröße und Morphologie von Nanosystemen ist für alle Aufsichtsbehörden obligatorisch, und es gibt eine Vielzahl von Methoden, um diese Eigenschaften zu untersuchen. Diese reichen von Routinemethoden wie dynamischer Lichtstreuung (DLS) und Nanopartikel-Tracking-Analyse (NTA) bis hin zu komplexeren Techniken wie Kleinwinkel-Röntgenstreuung (SAXS) und mikroskopiebasierten Techniken (d. h. Transmissionselektronenmikroskopie, TEM, und kryogene Transmissionselektronenmikroskopie, Kryo-TEM; Rasterkraftmikroskopie, AFM), die auch wichtige strukturelle Informationen liefern.
Das wurde tatsächlich mittel DLS gemacht.
Das am besten geeignete Charakterisierungswerkzeug sollte je nach Art des untersuchten Nanosystems ausgewählt werden. Beispielsweise ist Kryo-TEM eine geeignete Methode zur Untersuchung der Struktur von Liposomen, einschließlich der Umwandlung von Liposomen in Mizellen, der weiteren Komplexierung mit chemischen Wirkstoffen und Nukleinsäuren, und es ist auch ein leistungsfähiges Werkzeug für die Analyse von Kern-Schale-Nanopartikeln, aber beispielsweise ist es keine Technik der Wahl im Fall von Polymermatrizen wie Poly(Milchsäure-co-Glykolsäure) (PLGA)-Nanopartikeln nicht die Technik der Wahl.
Genaus das wurde im bereits mehrfach erwähnten Preprint 2025 endlich gemacht. Warum haben das BioNTech/Pfizer eigentlich nicht gemacht?
Es muss jedoch auch betont werden, dass die Prüfung der Leistungsfähigkeit von Nanosystemen in biologischen Modellen zusätzliche Herausforderungen mit sich bringt. Tatsächlich können die Eigenschaften biorelevanter Medien und/oder biologischer Bestandteile (z. B. Zellen, Gewebe) die biopharmazeutische Leistungsfähigkeit von Nanosystemen beeinflussen. So ist beispielsweise bekannt, dass bei derselben Zelllinie oder demselben Tiermodell Unterschiede im Phänotyp die Fähigkeit zur Interaktion mit Nanosystemen beeinträchtigen können. Außerdem ist dokumentiert, dass kleine Veränderungen in den Wachstumsbedingungen einer Zelllinie (z. B. Wachstumsmedium, Inkubationsbedingungen, Zellpopulation) zu signifikanten Unterschieden in ihrer Fähigkeit zur Aufnahme derselben Nanosysteme führten.
Kleinste Unterschiede bei Zelllinien beeinflussen bereits wie die LNPs mit den Zellen interagieren. ZELLLINIEN!!! Das ist ein Zelltyp. Ein definierter Zelltyp unter kontrollierten Bedingungen! Wie sieht es da bei Menschen aus? Verschiedene Zelltypen, verschiedene Wachstumsmedien/Ernährung/Ernährungszustand…
Beispielsweise stellt das NCI NCL auf seiner Website mehrere Protokolle zur physikalisch-chemischen Charakterisierung von Nanosystemen (z. B. Größe/Größenverteilung, Lösungseigenschaften, Oberflächenchemie, Nanosystemkonzentration), zur immunologischen Charakterisierung (z. B. Komplementaktivierung, Phagozytose) und zu anderen pharmakologischen und toxikologischen Bewertungen (z. B. Zytotoxizität, oxidativer Stress) zur Verfügung.
Leider fehlt an dieser Stelle die Referenz bzw. der Link, welche Protokolle genau gemeint sind.
Möglicherweise meinen die Autoren den Bereich “Nanotechnology Protocols and Capabilities”. Ich gehe davon aus, dass diese Untersuchungen für die modRNA-Produkte nicht durchgeführt wurden.
Die Festlegung der Versuchsparameter oder die Wahl der Analysetechnik kann je nach Quelle (z. B. NCI-NCL, ISO, JRC) oder geografischem Referenzgebiet (z. B. EU vs. USA) variieren. Darüber hinaus fehlen im Gegensatz zu den von der Europäischen Kommission für Nanomaterialien erstellten Entscheidungsbäumen noch immer Entscheidungsbäume, mit denen die Charakterisierungskaskade definiert und priorisiert werden kann, die bei der pharmazeutischen Entwicklung einer bestimmten Klasse von Nanomedikamenten befolgt werden muss.
Manchmal ist internationale Zusammenarbeit und Abstimmung durchaus vorteilhaft. Wenn die WHO sich um solche Normen kümmern würde, würde sie tatsächlich was sinnvolles tun.
In diesem Zusammenhang haben die EMA und die FDA Empfehlungen für Nanomedizinprodukte herausgegeben und eine Expertengruppe eingerichtet, die zur Erreichung dieser regulatorischen Ziele beitragen soll.
Wenn man entsprechende Produkte aber nicht korrekt unter Nanomedizin einordnet, bringen einem auch Richtlinien nichts.
In dieser Hinsicht sollten die Regulierungsbehörden und die Wissenschaft Bemühungen unternehmen, um einen Konsens über eine eindeutige Definition von Nanomedikamenten zu erzielen, indem die Kriterien, die für eine bessere Qualifizierung von Nanotechnologien in ihrer Anwendung im pharmazeutischen Bereich nützlich sind, genauer spezifiziert werden. Beispielsweise sollte die aktualisierte Definition im Falle der Anwendung von Nanotechnologien zur Arzneimittelabgabe allgemeine Spezifikationen für die Polydispersität der Partikelgröße, die Morphologie und die Oberflächeneigenschaften sowie andere Parameter enthalten, die für eine genauere Charakterisierung ihrer biopharmazeutischen Eigenschaften relevant sind. Darüber hinaus bestehen trotz der Bemühungen der wissenschaftlichen Gemeinschaft nach wie vor Lücken in Bezug auf validierte und standardisierte Charakterisierungsmethoden für Nanosysteme.
Fußnotte 44 (im Paper 63) ist eine EU eigene Publikation aus dem Jahr 2019. Man weiß in der EU also über die Lücken bezüglich “validierter und standardisierter Charakterisierungsmethoden für Nanosysteme” und hat diese Art Technologie unter dem Namen “Impfstoff” einfach durchgewunken. Man hat also entsprechende Fachleute bei der EU. Warum haben die 2020 nicht gehandelt?
Bestehende Leitlinien der EMA und der FDA betonen die Notwendigkeit einer umfassenden Charakterisierung von Nanosystemen, um kritische Qualitätsmerkmale zu identifizieren, die sich auf die Wirksamkeit und das Sicherheitsprofil auswirken können, während private und wissenschaftliche Einrichtungen Protokolle und Verfahren zur Unterstützung der In-vitro-Charakterisierung von Nanomedikamenten veröffentlichen. Der derzeitige technische und regulatorische Rahmen ist jedoch noch weit davon entfernt, über routinemäßige und standardisierte/kompendiale Methoden zu verfügen, die von der pharmazeutischen Industrie zur Bewertung der qualitativen Gleichwertigkeit zwischen Chargen desselben Nanomedizinprodukts verwendet werden können.
Und damit haben wir ein komplett verschwörungsfreie Erklärung für die Todeschargen. Man kann die Gleichwertigkeit zwischen Chargen derselben Nanomedizin aktuell NICHT routinemäßig und standardisiert bestimmen und sicher stellen.
Was labern die Behörden also herum, dass es keine Chargenunterschiede gibt? Woher wollen die das wissen, wenn das gar nicht bestimmbar ist?
Beispielsweise ist zu beachten, dass die EMA-Leitlinien zwar die Bedeutung einer vollständigen Charakterisierung der Oberflächenzusammensetzung von PEGylierten Nanosystemen hervorheben, eine solche Charakterisierung jedoch auf der Verwendung mehrerer hochentwickelter Methoden basieren sollte, wobei ein harmonisierter multidisziplinärer Ansatz zu verfolgen ist, der bislang noch nicht definiert wurde. Auch dies schränkt die Aktualisierung der Guten Herstellungspraxis und die Fähigkeit der Regulierungsbehörden ein, spezifische und harmonisierte Konformitäts- und Standardkriterien für Chargenfreigabelabore von PEGylierten Nanomedizinprodukten bereitzustellen.
Zufällig fallen die modRNA-LNP Produkte unter PEGylierte Nanosysteme und leider hat man etwas zugelassen, dessen Charakterisierung noch nicht definiert wurde und wahrscheinlich immer noch nicht definiert ist. Hat jemand ein aktuelles Dokument der EMA zu diesem Thema? Die EMA Webseite ist so unübersichtlich.
Darüber hinaus sollten solche Flussdiagramme auch zwischen Methoden und Protokollen unterscheiden, die bei routinemäßigen Qualitätskontrollen verwendet werden können, und solchen, die eher für die pharmazeutische Entwicklung von First-in-Human-Produkten und/oder Vergleichbarkeitsstudien für Kopien/Nachfolgeprodukte geeignet sind. Bei Letzteren stellt die Gleichwertigkeit komplexer Nanomedikamente eine erhebliche wissenschaftliche, medizinische und regulatorische Herausforderung dar, wenn es darum geht, den Nachweis einer ausreichenden Ähnlichkeit zu erbringen.
Falls sich jemand fragt, wie es zu den großen Chargendifferenzen kommen konnte: Das ist eine “erhebliche, wissenschaftliche, medizinische und regulatorische Herausforderung”. Daher müssen wir erst einmal mit Todeschargen leben.
In diesem Zusammenhang wurden Kriterien für die Auswahl und Charakterisierung von Nanosimilars vorgeschlagen. Dazu gehören mindestens: Partikelgröße und Größenverteilung, Partikeloberflächeneigenschaften, Anteil der nicht gebundenen bioaktiven Moleküle, Lagerstabilität, Aufnahme und Verteilung der bioaktiven Moleküle sowie Stabilität gebrauchsfertiger Präparate. Darüber hinaus sollte ein Qualitätsvergleich auch die Bewertung der Stabilität von Folge-Nanomedikamenten im Plasma und die Charakterisierung ihres Proteinkorona-Musters im Vergleich zum Original-Nanomedikament umfassen. Zusätzlich dazu können je nach Klasse der Nanomedikamentprodukte und den vorgesehenen therapeutischen Indikationen In-vitro-Zellkulturstudien erforderlich sein.
Und das sind nur die Minimalanforderungen. Nicht einmal diese wurde erfüllt. Gemessen wurde maximal die Partikelgröße und die Größenverteilung. Das mit der Lagerstabilität haben unabhängige Forscher untersucht.
Um den Herausforderungen zu begegnen, die sich aus der zunehmenden Vermarktung von Nanomedikamenten ergeben, sollte in Zukunft ein integrierter und einheitlicher Ansatz für deren Bewertung entwickelt und zwischen akademischen Einrichtungen, industriellen Akteuren und Aufsichtsbehörden abgestimmt werden.
Der Artikel ist von 2023 und spricht von der Zukunft. Dieser einheitliche Ansatz war 2020 also nicht vorhanden.
Mein Fazit:
Hätte man die modRNA-LNP Produkte als Nanomedizin klassifiziert, wären sie an den Anforderungshürden der Zulassung gescheitert.
Das eröffnet vielleicht juristisch eine neue Flanke?
Domb AJ, Sharifzadeh G, Nahum V, Hosseinkhani H. Safety Evaluation of Nanotechnology Products. Pharmaceutics. 2021 Oct 4;13(10):1615. doi: 10.3390/pharmaceutics13101615. PMID: 34683908; PMCID: PMC8539492. https://pubmed.ncbi.nlm.nih.gov/34683908/
*FOI 2389 document 6 https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf
Rocco P, Musazzi UM, Franzè S, Minghetti P. Copies of nonbiological complex drugs: generic, hybrid or biosimilar? Drug Discov Today. 2019 Jan;24(1):250-255. doi: 10.1016/j.drudis.2018.08.003. Epub 2018 Aug 4. PMID: 30086403. https://pubmed.ncbi.nlm.nih.gov/30086403/
Vitriol, D. V. (2023a, May 9). Liste der BioNTech/Pfizer Zulieferer (Work in Progress). DrBine’s Newsletter.
Vitriol, D. V. (2024c, November 9). Wie sauber sind die Lipide ALC-0315 und ALC-0159 und sind sie überhaupt korrekt registriert? DrBine’s Newsletter.
Vitriol, D. V. (2025b, March 23). Wo verbleiben die körperfremden Lipide? DrBine’s Newsletter.
Vitriol, D. V. (2025d, August 13). Die potentiell toxische Chiralität von ALC-0315. DrBine’s Newsletter.
Vitriol, D. V. (2025e, December 20). Höhere Nebenwirkungsrate bei ungenauer Zusammensetzung der LNPs? DrBine’s Newsletter.
Priority-OCs-in-quality-LoQ-COVID-19-mRNA-Vaccine-BioNTech.docx S. 32 https://view.officeapps.live.com/op/view.aspx?src=https%3A%2F%2Fwww.covidtruths.co.uk%2Fwp-content%2Fuploads%2F2021%2F04%2FPriority-OCs-in-quality-LoQ-COVID-19-mRNA-Vaccine-BioNTech.docx&wdOrigin=BROWSELINK
Musazzi UM, Marini V, Casiraghi A, Minghetti P. Is the European regulatory framework sufficient to assure the safety of citizens using health products containing nanomaterials? Drug Discov Today. 2017 Jun;22(6):870-882. doi: 10.1016/j.drudis.2017.01.016. Epub 2017 Feb 9. PMID: 28189800. https://pubmed.ncbi.nlm.nih.gov/28189800/
Food and Drug Administration (FDA), Nanotechnology Guidance Documents, https://www.fda.gov/science-research/nanotechnology-programs-fda/nanotechnology-guidance-documents, 2018, (accessed: June 2023).
European Medicines Agency (EMA), Multidisciplinary: Nanomedicines, https://www.ema.europa.eu/en/human-regulatory/research-development/scientific-guidelines/multidisciplinary/multidisciplinary-nanomedicines, 2022, (accessed: June 2023).
Funk F, Flühmann B, Barton AE. Criticality of Surface Characteristics of Intravenous Iron-Carbohydrate Nanoparticle Complexes: Implications for Pharmacokinetics and Pharmacodynamics. Int J Mol Sci. 2022 Feb 15;23(4):2140. doi: 10.3390/ijms23042140. Erratum in: Int J Mol Sci. 2022 Sep 06;23(18):10230. doi: 10.3390/ijms231810230. PMID: 35216261; PMCID: PMC8878488. https://pubmed.ncbi.nlm.nih.gov/35216261/
Minghetti P, Musazzi UM, Dorati R, Rocco P. The safety of tattoo inks: Possible options for a common regulatory framework. Sci Total Environ. 2019 Feb 15;651(Pt 1):634-637. doi: 10.1016/j.scitotenv.2018.09.178. Epub 2018 Sep 15. PMID: 30245419. https://pubmed.ncbi.nlm.nih.gov/30245419/
National Institutes of Health, Protocols and Capabilities from the Nanotechnology Characterization Lab https://www.cancer.gov/nano/research/ncl/protocols-capabilities, 2023, (accessed: June 2023).
European Commission, Commission Recommendation of 10.6.2022 on the Definition of Nanomaterial, https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A32022H0614%2801%29, 2022, (accessed: June 2023).
Crommelin DJ, de Vlieger JS, Weinstein V, Mühlebach S, Shah VP, Schellekens H. Different pharmaceutical products need similar terminology. AAPS J. 2014 Jan;16(1):11-4. doi: 10.1208/s12248-013-9532-0. Epub 2013 Sep 25. PMID: 24065599; PMCID: PMC3889525. https://pubmed.ncbi.nlm.nih.gov/24065599/
Soares S, Sousa J, Pais A, Vitorino C. Nanomedicine: Principles, Properties, and Regulatory Issues. Front Chem. 2018 Aug 20;6:360. doi: 10.3389/fchem.2018.00360. PMID: 30177965; PMCID: PMC6109690. https://pubmed.ncbi.nlm.nih.gov/30177965/
Vitriol, D. V. (2026, February 16). DSPC bindet die meisten Proteine, DOPE gar keine. Daher hat man DSPC genommen. DrBine’s Newsletter.
Vitriol, D. V. (2025d, April 18). LNPs und ihre Protein-Corona. DrBine’s Newsletter.
Vitriol, D. V. (2023a, May 9). Liste der BioNTech/Pfizer Zulieferer (Work in Progress). DrBine’s Newsletter. https://drbine.substack.com/p/liste-der-biontech-zulieferer-work
Food and Drug Administration (FDA), Nanotechnology Guidance Documents, https://www.fda.gov/science-research/nanotechnology-programs-fda/nanotechnology-guidance-documents, 2018, (accessed: June 2023).
European Medicines Agency (EMA), Multidisciplinary: Nanomedicines, https://www.ema.europa.eu/en/human-regulatory/research-development/scientific-guidelines/multidisciplinary/multidisciplinary-nanomedicines, 2022, (accessed: June 2023).
Minghetti P, Rocco P, Schellekens H. The constrained prescription, interchangeability and substitution of biosimilars. Nat Biotechnol. 2015 Jul;33(7):688-9. doi: 10.1038/nbt.3272. PMID: 26154003. https://pubmed.ncbi.nlm.nih.gov/26154003/
Soares S, Sousa J, Pais A, Vitorino C. Nanomedicine: Principles, Properties, and Regulatory Issues. Front Chem. 2018 Aug 20;6:360. doi: 10.3389/fchem.2018.00360. PMID: 30177965; PMCID: PMC6109690. https://pubmed.ncbi.nlm.nih.gov/30177965/
Vitriol, D. V. (2023d, November 20). Die Plörre ist wohl innen flüssig. DrBine’s Newsletter.
Priority-OCs-in-quality-LoQ-COVID-19-mRNA-Vaccine-BioNTech.docx S. 32 https://view.officeapps.live.com/op/view.aspx?src=https%3A%2F%2Fwww.covidtruths.co.uk%2Fwp-content%2Fuploads%2F2021%2F04%2FPriority-OCs-in-quality-LoQ-COVID-19-mRNA-Vaccine-BioNTech.docx&wdOrigin=BROWSELINK
Domb AJ, Sharifzadeh G, Nahum V, Hosseinkhani H. Safety Evaluation of Nanotechnology Products. Pharmaceutics. 2021 Oct 4;13(10):1615. doi: 10.3390/pharmaceutics13101615. PMID: 34683908; PMCID: PMC8539492. https://pubmed.ncbi.nlm.nih.gov/34683908/
Epstein-Barash H, Gutman D, Markovsky E, Mishan-Eisenberg G, Koroukhov N, Szebeni J, Golomb G. Physicochemical parameters affecting liposomal bisphosphonates bioactivity for restenosis therapy: internalization, cell inhibition, activation of cytokines and complement, and mechanism of cell death. J Control Release. 2010 Sep 1;146(2):182-95. doi: 10.1016/j.jconrel.2010.03.011. Epub 2010 Mar 30. PMID: 20359513. https://pubmed.ncbi.nlm.nih.gov/20359513/
Hirn S, Semmler-Behnke M, Schleh C, Wenk A, Lipka J, Schäffler M, Takenaka S, Möller W, Schmid G, Simon U, Kreyling WG. Particle size-dependent and surface charge-dependent biodistribution of gold nanoparticles after intravenous administration. Eur J Pharm Biopharm. 2011 Apr;77(3):407-16. doi: 10.1016/j.ejpb.2010.12.029. Epub 2010 Dec 31. PMID: 21195759; PMCID: PMC3051057. https://pubmed.ncbi.nlm.nih.gov/21195759/
JW-v-HHS-prod-3-02418.pdf https://www.judicialwatch.org/wp-content/uploads/2022/03/JW-v-HHS-prod-3-02418.pdf
Grumelot, S., Mohammed, N., Colonrosado, J., Sadeghi, S. A., Fang, F., Hilsen, K., Shango, B., Saei, A. A., Murray, A. M., Mitchell, M. J., Borhan, B., Sun, L., Vali, H., Whitehead, K. A., & Mahmoudi, M. (2025). Lipid nanoparticle protein coronas form via lipoprotein fusion rather than shell-like adsorption. Biorxiv. https://doi.org/10.64898/2025.12.21.695162, https://www.biorxiv.org/content/10.64898/2025.12.21.695162v1.full.pdf
Woodle MC, Matthay KK, Newman MS, Hidayat JE, Collins LR, Redemann C, Martin FJ, Papahadjopoulos D. Versatility in lipid compositions showing prolonged circulation with sterically stabilized liposomes. Biochim Biophys Acta. 1992 Apr 13;1105(2):193-200. doi: 10.1016/0005-2736(92)90194-q. PMID: 1586658. https://pubmed.ncbi.nlm.nih.gov/1586658/
Grumelot, S., Mohammed, N., Colonrosado, J., Sadeghi, S. A., Fang, F., Hilsen, K., Shango, B., Saei, A. A., Murray, A. M., Mitchell, M. J., Borhan, B., Sun, L., Vali, H., Whitehead, K. A., & Mahmoudi, M. (2025). Lipid nanoparticle protein coronas form via lipoprotein fusion rather than shell-like adsorption. Biorxiv. https://doi.org/10.64898/2025.12.21.695162, https://www.biorxiv.org/content/10.64898/2025.12.21.695162v1.full.pdf
Rocco P, Musazzi UM, Franzè S, Minghetti P. Copies of nonbiological complex drugs: generic, hybrid or biosimilar? Drug Discov Today. 2019 Jan;24(1):250-255. doi: 10.1016/j.drudis.2018.08.003. Epub 2018 Aug 4. PMID: 30086403. https://pubmed.ncbi.nlm.nih.gov/30086403/
Grumelot, S., Mohammed, N., Colonrosado, J., Sadeghi, S. A., Fang, F., Hilsen, K., Shango, B., Saei, A. A., Murray, A. M., Mitchell, M. J., Borhan, B., Sun, L., Vali, H., Whitehead, K. A., & Mahmoudi, M. (2025). Lipid nanoparticle protein coronas form via lipoprotein fusion rather than shell-like adsorption. Biorxiv. https://doi.org/10.64898/2025.12.21.695162, https://www.biorxiv.org/content/10.64898/2025.12.21.695162v1.full.pdf
Cortez-Jugo C, Czuba-Wojnilowicz E, Tan A, Caruso F. A Focus on “Bio” in Bio-Nanoscience: The Impact of Biological Factors on Nanomaterial Interactions. Adv Healthc Mater. 2021 Aug;10(16):e2100574. doi: 10.1002/adhm.202100574. Epub 2021 Jun 25. PMID: 34170631. https://pubmed.ncbi.nlm.nih.gov/34170631/
Nanotechnology Characterization Laboratory – NCI https://dctd.cancer.gov/research/research-areas/nanotech/ncl
Rocco P, Musazzi UM, Franzè S, Minghetti P. Copies of nonbiological complex drugs: generic, hybrid or biosimilar? Drug Discov Today. 2019 Jan;24(1):250-255. doi: 10.1016/j.drudis.2018.08.003. Epub 2018 Aug 4. PMID: 30086403. https://pubmed.ncbi.nlm.nih.gov/30086403/
Food and Drug Administration (FDA), Nanotechnology Guidance Documents, https://www.fda.gov/science-research/nanotechnology-programs-fda/nanotechnology-guidance-documents, 2018, (accessed: June 2023).
European Medicines Agency (EMA), Multidisciplinary: Nanomedicines, https://www.ema.europa.eu/en/human-regulatory/research-development/scientific-guidelines/multidisciplinary/multidisciplinary-nanomedicines, 2022, (accessed: June 2023).
Identification of nanomaterials through measurements: Points to Consider in the Assessment of Particulate Materials According to the European Commission’s Recommendation on a Definition of Nanomaterial. (2019). https://publications.jrc.ec.europa.eu/repository/bitstream/JRC118158/kjna29942enn.pdf
European Medicines Agency (EMA), Reflection Paper on Surface Coating: General Issues for Consideration Regarding Parenteral Administration of Coated Nanomedicine Products, EMA/325027/2013, 2013. https://etp-nanomedicine.eu/wp-content/uploads/2018/10/reflection-paper-surface-coatings-general-issues-consideration-regarding-parenteral-administration_en.pdf
European Medicines Agency (EMA), Reflection Paper on the Data Requirements for Intravenous Liposomal Products Developed with Reference to an Innovator Liposomal Product, EMA/CHMP/806058/2009/Rev. 02, 2013 https://etp-nanomedicine.eu/wp-content/uploads/2018/10/reflection-paper-data-requirements-intravenous-liposomal-products-developed-reference-innovator_en-0.pdf
Astier A, Barton Pai A, Bissig M, Crommelin DJA, Flühmann B, Hecq JD, Knoeff J, Lipp HP, Morell-Baladrón A, Mühlebach S. How to select a nanosimilar. Ann N Y Acad Sci. 2017 Nov;1407(1):50-62. doi: 10.1111/nyas.13382. Epub 2017 Jul 17. PMID: 28715605. https://pubmed.ncbi.nlm.nih.gov/28715605/
Vitriol, D. V. (2024a, May 15). Die Plörre ist stabiler als gehofft. DrBine’s Newsletter.
🔗 Quelle: https://drbine.substack.com/p/was-ware-wenn-man-die-modrna-lnps