Zwei neue Publikationen widmen sich dem Thema, wie das Sars-CoV2 Virus bzw. das Spike-Protein Einfluss auf die Fruchtbarkeit nehmen.
COVID-19-Impfung während oder kurz vor der Schwangerschaft und hypertensive Schwangerschaftserkrankungen
Bluthochdruck in der Schwangerschaft sind ein bekanntes Problem, das laut AOK ca. 40 von 1000 Schwangere betrifft.
“Durch den hohen Druck, der bei einer Präeklampsie in den Blutgefäßen herrscht, können diese beschädigt werden. Das kann die Blutgefäße der Mutter betreffen, aber auch die Blutgefäße in der Plazenta. Dadurch wird das Kind nicht mehr mit genügend Nährstoffen und Sauerstoff versorgt und Wachstumsstörungen, Spätschäden sowie Fehl- oder Totgeburten sind möglich.”
Die AOK ist keine wissenschaftlich belastbare Quelle, aber wenn dieses Wissen schon auf der Internetseite der Krankenkasse steht, kann man es wohl als Allgemeinwissen voraussetzen.
Das CDC hat eine Studie durchgeführt, wo sie gegen COVID injizierte Schwangere mit nicht injizierten Schwangeren verglichen haben.
Hypertonische Schwangerschaftserkrankungen (HDP) sind die Hauptursachen für Morbidität und Mortalität bei Müttern und Föten. Um potenzielle Sicherheitsbedenken zu identifizieren, haben wir untersucht, ob eine COVID-19-Impfung während der Schwangerschaft oder innerhalb von 30 Tagen nach der letzten Menstruation mit selbst gemeldeten HDP in Verbindung steht. Außerdem haben wir das HDP-Risiko im Zusammenhang mit einer COVID-19-Erkrankung während der Schwangerschaft untersucht.
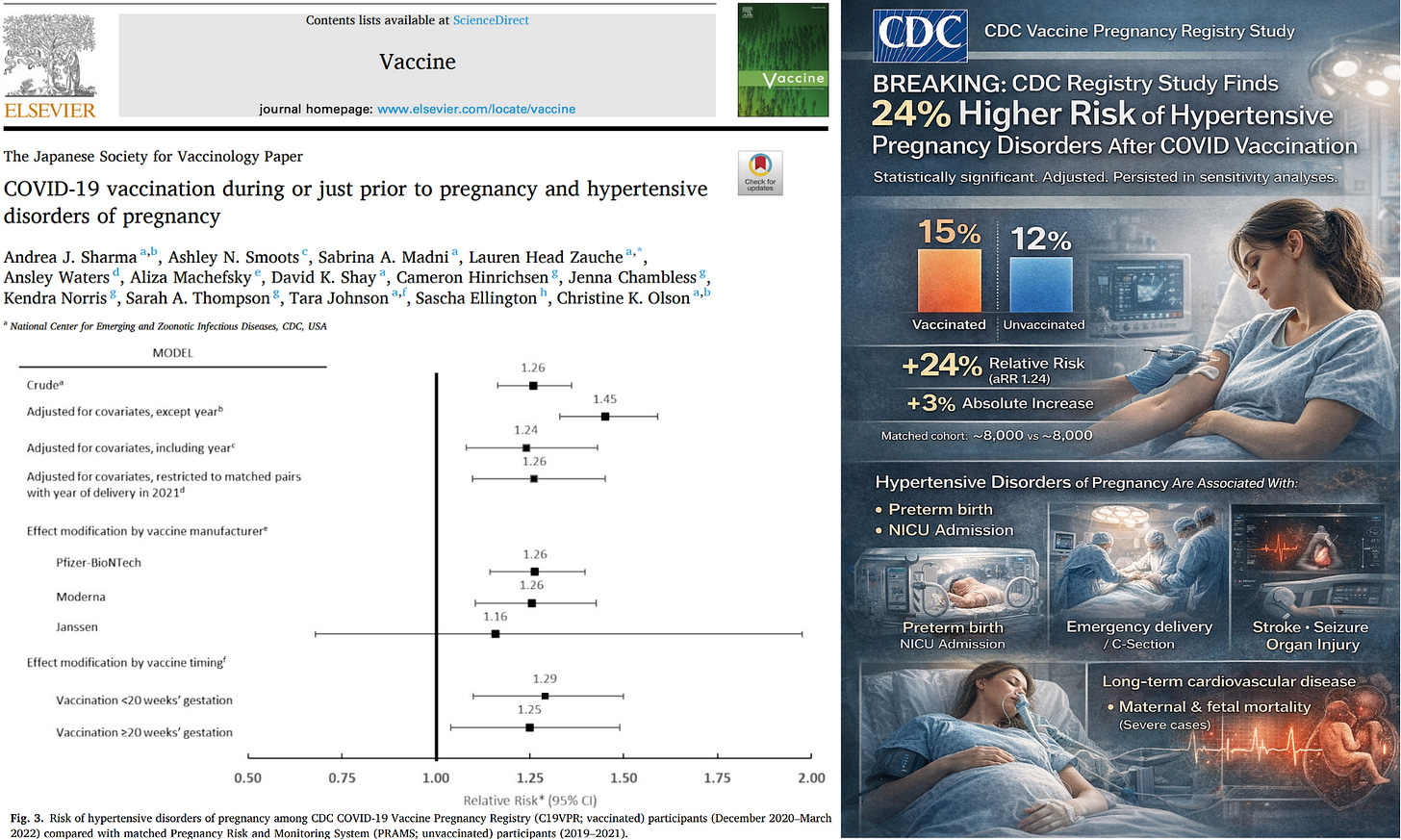
Wir haben in der C19VPR-Kohorte ein erhöhtes Risiko für HDP nach einer COVID-19-Impfung festgestellt;
der Rest der Schlussfolgerungen sind Beschwichtigungsplattitüden.
Ein Grund für Frühgeburten bei geimpften Frauen könnte also Bluthochdruck sein, der möglicherweise durch die Deregulierung des RAAS Systems verursacht ist.
Nicholas Hulscher hat das Paper schön zusammengefasst:
“Die beobachtete absolute Differenz betrug 3 Prozentpunkte. Das bedeutet etwa 1 zusätzlichen Fall von hypertensiven Schwangerschaftskomplikationen pro 33 geimpften Schwangerschaften. Wenn weltweit sogar 40 bis 60 Millionen schwangere Frauen während der globalen Einführungsphase eine COVID-19-Impfung erhalten hätten, würde ein absoluter Anstieg von 3 % zu schätzungsweise 1,2 bis 1,8 Millionen zusätzlichen Fällen von hypertensiven Schwangerschaftskomplikationen weltweit führen.”
Eine durch inaktiviertes SARS-CoV-2-Virus verursachte Entzündung wirkt sich direkt auf die Spermatogenese und die Fortpflanzungsfähigkeit aus und führt bei transgenen K-18-hECA2-Mäusen zu einer Beeinträchtigung des Fötus.
Diese Publikation ist nur ein Preprint, die vielleicht nie in einer wissenschaftlichen Zeitschrift erscheinen wird. Da es sich um ein Preprint handelt, hat der Artikel noch so seine Schwächen. Das Experiment an sich ist aber interessant.
“K18-hACE2-transgene Mäuse exprimieren humanes ACE2, den Rezeptor, über den das schwere akute respiratorische Syndrom Coronavirus (SARS-CoV) in die Zellen eindringt. Der humane Keratin-18-Promotor steuert die Expression in Epithelien, einschließlich der Atemwegsepithelien, wo Infektionen typischerweise beginnen. Da K18-hACE2 für SARS-CoV-2- und SARS-CoV-Viren empfänglich sind, eignen sie sich für die Erforschung antiviraler Therapien gegen COVID-19 und SARS.”
Die Autoren züchteten sich das Virus in Zellkultur und töteten es ab, für die Versuche.
Das SARS-CoV-2-Virus, Stamm WUHAN, wurde in der VERO CCL81-Zelllinie mit einem Titer von 1,25 x 106 PFU/ml in einem Labor der Biosicherheitsstufe 3 der UFMG hergestellt. Das Virus wurde durch Inkubation mit einer 4%igen Paraformaldehydlösung für 1 Stunde und anschließender Bestrahlung mit UV-Licht für eine weitere Stunde inaktiviert. Die Inaktivierung wurde durch einen Plaque-Assay bestätigt, wie zuvor von unserer Gruppe beschrieben [15].
Die Mäuse wurden nasal infiziert auf eine sehr extreme Art:
Um die Auswirkungen des Virus während der Trächtigkeit zu beurteilen, wurden die Weibchen nach der Paarung, die einen Vaginalpfropfen aufwiesen, mit Ketamin (90 mg/kg) und Xylazin (10 mg/kg) betäubt und während der ersten 7 Tage der Trächtigkeit (Zeitraum der Embryoimplantation) täglich mit 5 µL/Nasenloch von 1×105 PFU des iSARS-CoV-2-Virus behandelt.
Um zu beurteilen, ob das iSARS-CoV-2-Virus die Spermienproduktion beeinträchtigen könnte, wurden männliche Mäuse mit Ketamin (90 mg/kg) und Xylazin (10 mg/kg) betäubt und zwei Wochen lang täglich mit 5 µl/Nasenloch mit 1×105 PFU des iSARS-CoV-2-Virus infiziert.
Weibchen:
Weibchen, denen in den ersten sieben Tagen der Trächtigkeit das iSARS-CoV-2-Virus injiziert wurde, weisen signifikante histologische Veränderungen im Lungengewebe auf.
Weibchen, denen während der Embryonalimplantationsphase das iSARS-CoV-2 injiziert wurde, zeigten keine histologischen Veränderungen in der Plazenta.
K18-hECA2-Weibchen, denen das Virus während der Embryonalimplantationsphase instilliert wurde, zeigten signifikante reproduktive Veränderungen, darunter eine Verringerung der Anzahl lebensfähiger Föten, eine Zunahme der Anzahl embryonaler Resorptionen und Anzeichen einer mütterlichen Toxizität, die sich in einer geringen oder fehlenden Gewichtszunahme während der Schwangerschaft äußerte. Darüber hinaus zeigten die Weibchen eine verminderte Plazentaeffizienz, was auf eine direkte Beeinträchtigung der Plazentafunktion hindeutet.
[…]
Diese Ergebnisse stimmen mit früheren Studien überein, die unter Verwendung des K18-hACE2-Modells gezeigt haben, dass eine Infektion mit dem SARS-CoV-2-Virus oder die Exposition gegenüber der rekombinanten SARS-CoV-2-Spike-Protein-S1-Untereinheit eine verschlimmerte Entzündungsreaktion auslöste, die durch erhöhte Entzündungszytokinspiegel, schwere Lungenverletzungen, erhöhte Gefäßpermeabilität und beeinträchtigte Epithelbarrierefunktion gekennzeichnet war – Veränderungen, die denen ähneln, die bei Patienten mit schwerem COVID-19 beobachtet wurden [5, 27, 56]. Diese Ergebnisse deuten darauf hin, dass strukturelle Komponenten des Virus, unabhängig von der Virusreplikation, das angeborene Immunsystem signifikant aktivieren [53, 24, 32].
Männchen:
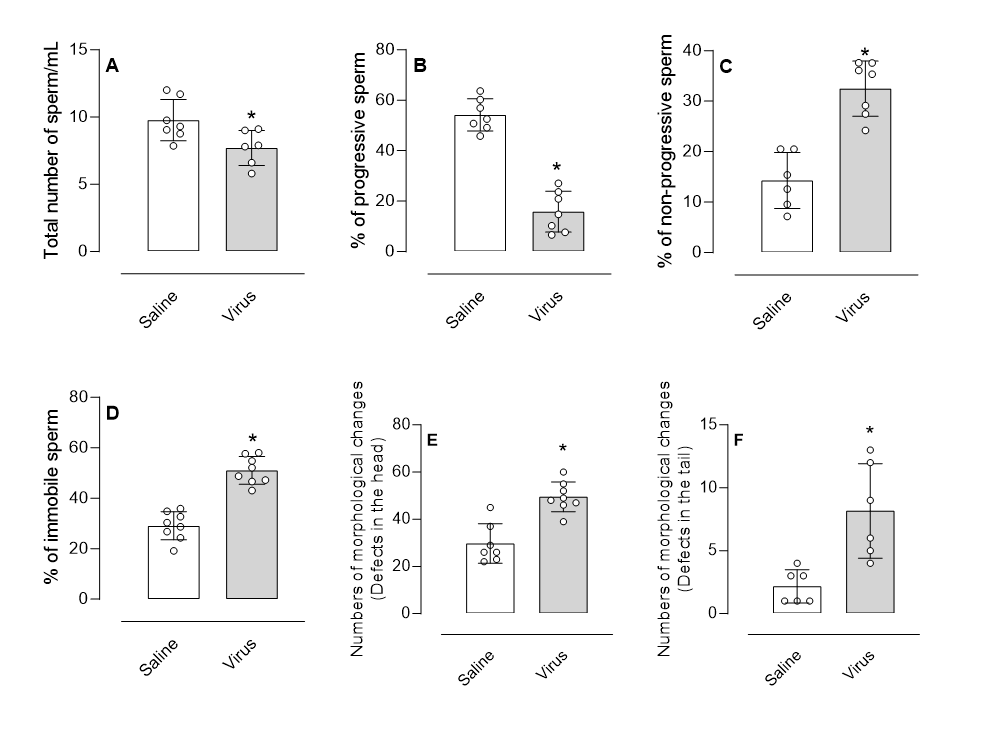
In Abb. 4A ist jedoch eine signifikante Verringerung der Gesamtzahl der Spermien um 18 % in der Gruppe mit iSARS-CoV-2-Virus-Instillation zu beobachten. Überraschenderweise wurde auch eine signifikante Veränderung in der Klassifizierung der Beweglichkeit dieser Spermien festgestellt. Es wurde ein prozentuales Verhältnis zwischen jeder Klassifizierung (A+B, C oder D) und der Gesamtzahl der Spermien hergestellt. So zeigt Abb. 4B, dass es zu einer signifikanten Verringerung des Anteils progressiver Spermien (A+B) um 70,5 % und folglich zu einem Anstieg des Anteils nicht progressiver und unbeweglicher Spermien um 127 % bzw. 76 % kam (Abb. 4C und 4D).
Abbildung 4.
Auswirkungen der Instillation von iSARS-CoV-2 auf die Spermienparameter und -morphologie bei K18-hACE2-Mäusen. Männlichen Mäusen wurden 14 Tage lang täglich 5 μl/Nasenloch mit 1×10⁵ PFU iSARS-CoV-2 oder Kochsalzlösung intranasal instilliert. Am Ende des Versuchszeitraums wurden die Tiere eingeschläfert, und die Nebenhoden und Samenleiter wurden beidseitig entnommen und in einem geeigneten Puffer inkubiert, um die Spermienmigration zu ermöglichen. (A) Gesamtzahl der Spermien; (B) Prozentsatz der progressiven Spermien; (C) Prozentsatz der nicht progressiven Spermien; (D) Prozentsatz der nicht beweglichen Spermien. Für die morphologische Analyse wurden die Spermienproben auf Objektträger aufgetragen, mit einem Panoptic-Färbekit gefärbt und unter einem Lichtmikroskop bei 100-facher Vergrößerung analysiert. (E) Defekte am Spermienkopf; (F) Defekte am Spermienhinterteil. Die Ergebnisse werden als Mittelwert ± Standardabweichung (n = 6–8) dargestellt. Die statistische Analyse erfolgte mittels Student-t-Test, gefolgt von einem Mann-Whitney-Post-Test. * p < 0,05 beim Vergleich von Mäusen, denen das Virus injiziert wurde, mit Mäusen, denen Kochsalzlösung injiziert wurde.
Angesichts der Tatsache, dass die bei trächtigen Weibchen beobachteten Auswirkungen die Fähigkeit des Virus belegen, die Trächtigkeit zu beeinträchtigen und eine Lungenentzündung auszulösen, haben wir unsere Studie erweitert, um zu untersuchen, ob bei K18-hACE2-Männchen, denen das iSARS-CoV-2-Virus injiziert wurde, Veränderungen der Spermien und/oder eine Beeinträchtigung der Fortpflanzungsfähigkeit auftreten können. Unsere Ergebnisse zeigten eine Verringerung der Gesamtzahl der Spermien, einen Rückgang der progressiven Spermien und einen Anstieg der nicht-progressiven Spermien mit abnormalen Bewegungen oder Unbeweglichkeit. Darüber hinaus ergab die morphologische Analyse einen signifikanten Anstieg struktureller Anomalien, insbesondere im Bereich des Kopfes und des Schwanzes der Spermien bei Tieren, die dem inaktivierten Virus ausgesetzt waren. Die histologische Untersuchung der Hoden zeigte hingegen keine signifikanten Veränderungen, was darauf hindeutet, dass die beobachteten Auswirkungen eher mit einer Störung der Spermatogenese zusammenhängen.
Mein Fazit:
Das Experiment ist die Beschreibung eines beobachteten Effekts auf die Fruchtbarkeit von Mäusen, für den man keine abschließende Erklärung hat, aber sich eine mögliche Ursache ausdenken muss.
Mit der Hypothese der Autoren, dass es sich um Entzündungsreaktionen handelt, machen es sich die Autoren sehr einfach. Natürlich gibt es eine Entzündung, wenn man haufenweise Spike-Protein, gebunden an eine Virenhülle, auf die Schleimhäute träufelt. Das Spike-Protein aktiviert bei Menschen in den Schleimhäuten Mastzellen und Komplementsystem. Wie das bei Mäusen ist, kann ich nicht sagen. Mastzellaktivierung ist schlecht für die Fruchtbarkeit beim menschlichen Frauen, das ist nicht neu. Eine wirkliche biochemische Erklärung haben die Autoren nicht.
Schon das inaktivierte Virus nasal gegeben macht massive Fertilitätsprobleme bei Mäusen. Das Spike allein, das im Blut kursiert könnte somit schlimmer sein. Totes Virus ist natürlich nicht 1:1 auf reines Spike-Protein übertragbar, deutet aber auch an, was man in den Sinopharm Daten zu Sinovac gesehen hat. Harmlos war das chinesische Produkt somit auch nicht.
Interessant ist, dass das Spike-Protein bzw. das tote Virus bereits über die Schleimhäute die Spermatogenese reduziert. Das könnte auch bei Shedding ein Problem sein, das jedoch dosisabhängig sein könnte. Das wäre näher zu untersuchen.
Gesundheitskasse, A.-. D. (2023, July 12). Präeklampsie in der Schwangerschaft erkennen und behandeln. AOK – Die Gesundheitskasse. https://www.aok.de/pk/magazin/familie/schwangerschaft/praeeklampsie-in-der-schwangerschaft-erkennen-und-behandeln/
Sharma AJ, Smoots AN, Madni SA, Zauche LH, Waters A, Machefsky A, Shay DK, Hinrichsen C, Chambless J, Norris K, Thompson SA, Johnson T, Ellington S, Olson CK. COVID-19 vaccination during or just prior to pregnancy and hypertensive disorders of pregnancy. Vaccine. 2026 Feb 2;75:128268. doi: 10.1016/j.vaccine.2026.128268. Epub ahead of print. PMID: 41633278. https://pubmed.ncbi.nlm.nih.gov/41633278/
Gesundheitskasse, A.-. D. (2023, July 12). Präeklampsie in der Schwangerschaft erkennen und behandeln. AOK – Die Gesundheitskasse. https://www.aok.de/pk/magazin/familie/schwangerschaft/praeeklampsie-in-der-schwangerschaft-erkennen-und-behandeln/
Mph, N. H. (2026, February 7). BREAKING: CDC study finds COVID shots increase the risk of a leading cause of maternal and fetal death by 24%. FOCAL POINTS (Courageous Discourse). https://www.thefocalpoints.com/p/breaking-cdc-study-finds-covid-shots
Patricia Fernandes, Patricia França, João pedro Paiva et al. Inflammation caused by inactivated SARS-CoV-2 virus directly impacts spermatogenesis and reproductive performance and causes fetal impairment in
K-18-hECA2 transgenic mice, 04 February 2026, PREPRINT (Version 1) available at Research Square [https://doi.org/10.21203/rs.3.rs-8681768/v1] https://www.researchsquare.com/article/rs-8681768/v1
034860 – K18-HACE2 strain details. (n.d.). https://www.jax.org/strain/034860
Szukiewicz D, Wojdasiewicz P, Watroba M, Szewczyk G. Mast Cell Activation Syndrome in COVID-19 and Female Reproductive Function: Theoretical Background vs. Accumulating Clinical Evidence. J Immunol Res. 2022 Jun 22;2022:9534163. doi: 10.1155/2022/9534163. PMID: 35785029; PMCID: PMC9242765. https://pubmed.ncbi.nlm.nih.gov/35785029/
Liu J, Wang J, Xu J, Xia H, Wang Y, Zhang C, Chen W, Zhang H, Liu Q, Zhu R, Shi Y, Shen Z, Xing Z, Gao W, Zhou L, Shao J, Shi J, Yang X, Deng Y, Wu L, Lin Q, Zheng C, Zhu W, Wang C, Sun YE, Liu Z. Comprehensive investigations revealed consistent pathophysiological alterations after vaccination with COVID-19 vaccines. Cell Discov. 2021 Oct 26;7(1):99. doi: 10.1038/s41421-021-00329-3. PMID: 34697287; PMCID: PMC8546144. https://pubmed.ncbi.nlm.nih.gov/34697287/
Die damalige Pressemeldung: Was ist V-Aids nach einer Impfung? Wie wird V-Aids diagnostiziert? | Presseportal https://www.presseportal.de/pm/119896/5249692