📅 16.02.2026 · Originalartikel lesen →
Dass LNP im Blut eines behandelten Lebewesens dessen Proteine als Corona haben ist nicht neu und bekannt. Darüber habe ich schon vor längerer Zeit geschrieben. Auch dass diese Eigenschaft von Mensch zu Mensch variieren kann, nicht verstanden ist und in der Zulassung der LNP-Technologie keine Rolle spielte, ja sogar nicht einmal erwähnt wurde.
Das bisherige Wissen zu Proteincoronas stammte aus technischen Gründen von festen Strukturen wie Polystyrol-oder Goldnanopartikeln.
LNPs sind jedoch alles andere als steife fixe Strukturen.
In einem Preprint Artikel aus dem Dezember 2025 berichten die Autoren, dass es ihnen gelungen ist, die Proteincorona auf LNPs mittels Kryoelektronenmikroskopie sichtbar zu machen.
Grumelot, S., Mohammed, N., Colonrosado, J., Sadeghi, S. A., Fang, F., Hilsen, K., Shango, B., Saei, A. A., Murray, A. M., Mitchell, M. J., Borhan, B., Sun, L., Vali, H., Whitehead, K. A., & Mahmoudi, M. (2025). Lipid nanoparticle protein coronas form via lipoprotein fusion rather than shell-like adsorption. Biorxiv. https://doi.org/10.64898/2025.12.21.695162, https://www.biorxiv.org/content/10.64898/2025.12.21.695162v1.full.pdf
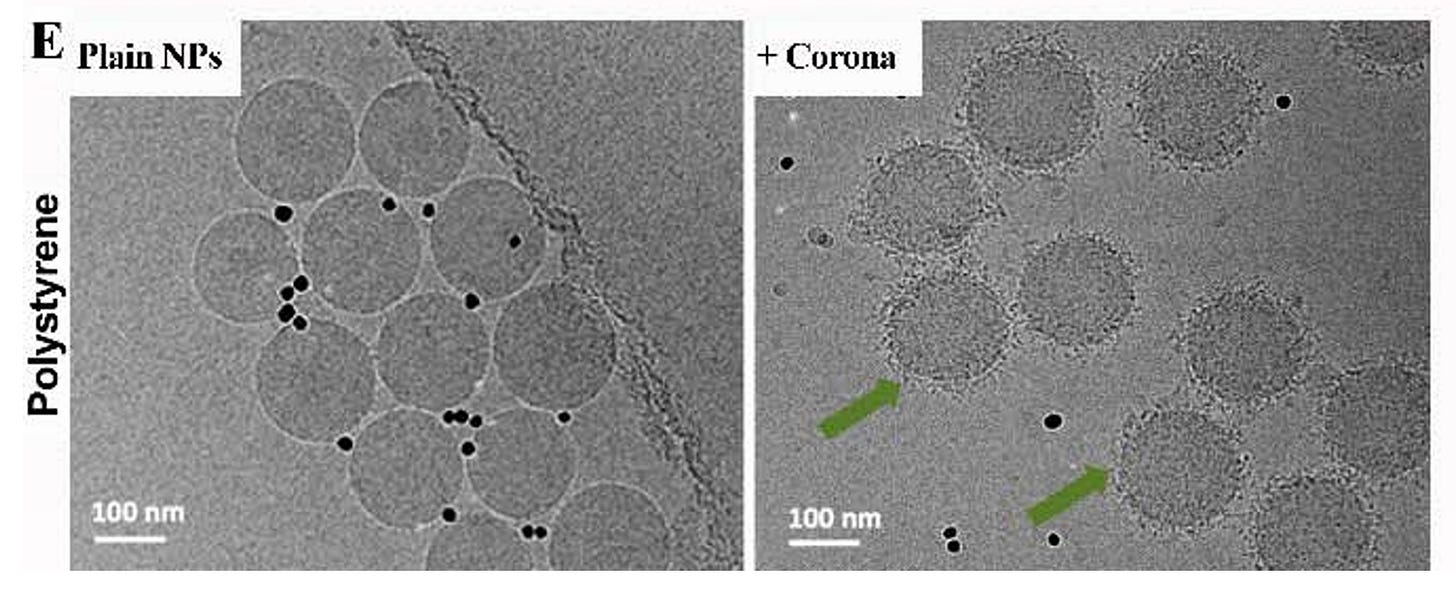
Zunächst haben die Autoren die klassischen Experimente repliziert und sich die Proteincoronas auf festen Körpern angeschaut wie Polystyrolpartikeln im Vergleich zu natürlichen extrazellulären Vesikeln.
Kryo-TEM-Bilder von Polystyrol-Nanopartikeln (100 nm und 200 nm) zeigen charakteristische unscharfe Proteinkronen (grüne Pfeile), während EVs solche Strukturen nicht aufweisen (rote Pfeile). Diese Ergebnisse deuten auf eine minimale oder fehlende Proteinkronenbildung auf EVs hin, was in deutlichem Kontrast zu der gut dokumentierten Kronenbildung auf Polystyrol-Nanopartikeln steht.
EV extrazelluläre Vesikel, hier stellvertretend für Exosomen und Mikrovesikel.
Natürliche Exosomen und andere extrazelluläre Vesikel scheinen sich keine Proteincorona zuzulegen oder verhindern irgendwie, das Proteine aus dem Blut binden.
Zum Vergleich: Polystyrol Nanopartikel und Goldnanopartikel:
Kryo-TEM-Bilder von Polystyrol- (100 nm) und Gold- (15 nm) Nanopartikeln vor und nach der Bildung einer Proteinkorona.
Diese Bilder der Goldpartikel und Polystyrolpartikel stammen eigentlich aus einer anderen Publikation und wurden mit Genehmigung der Autoren eines Artikels aus dem Jahr 2021 übernommen. Man könnte sagen, diese Bilder stellen den Wissensstand über die Proteincorona im Jahr 2021 dar.
Dass DNA oder Proteine an Goldpartikeln haften ist lange bekannt und wird in der Pflanzengenetik genutzt. Man beschichtet dafür Goldpartikel mit den gewünschten Genen und schießt diese auf Zellen mit kleinen Partikelkanonen. Einige Goldpartikel treffen Zellkerne und übertragen so das Gen mechanisch. Das zeigt auch, wie fest Biomoleküle an diese festen Partikel haften.
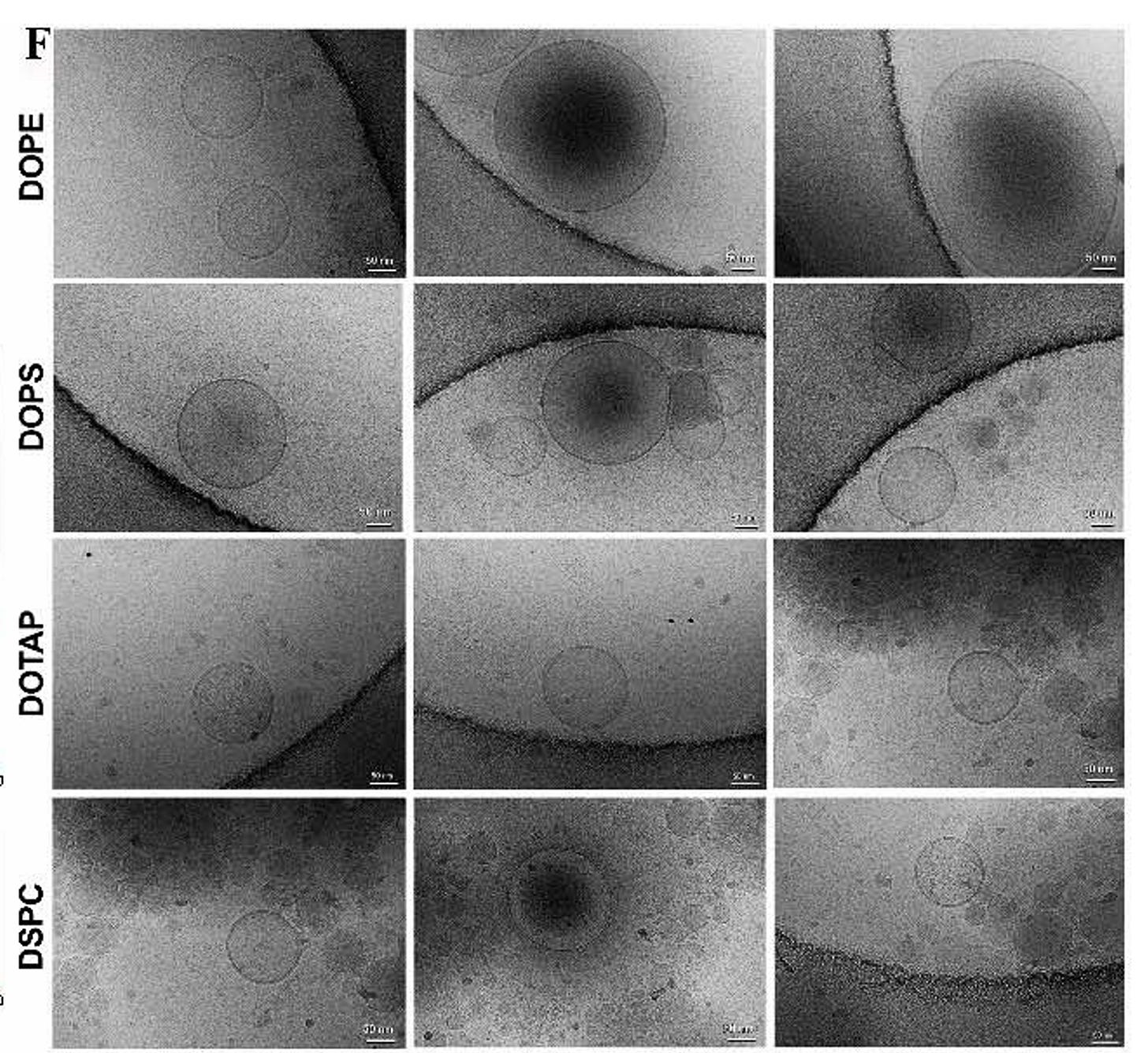
Anschließend haben dich die Autoren die Proteincoronas von LNPs im Kryo-Elektronenmikroskop angesehen.
Kryo-TEM-Bilder zeigen, dass LNPs keine peripheren unscharfen Proteinhüllen bilden, wie sie bei harten Nanopartikeln zu beobachten sind. Stattdessen weisen einige LNPs elektronendichte Strukturen auf, die mit Lipoproteinpartikeln übereinstimmen und in enger Verbindung mit LNP-Membranen stehen oder mit diesen verschmolzen sind (weitere Details siehe Abb. 2). Diese Morphologie war bei allen vier LNP-Formulierungen konsistent.
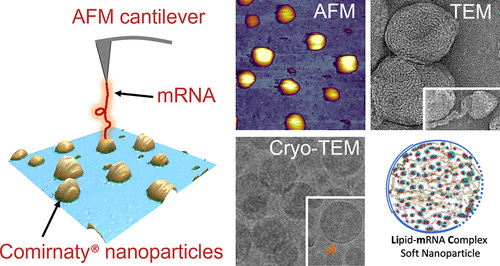
Das passt auch zur Darstellung der LNPs als unsymmetrische Strukturen in diesem Artikel, der zeigt, dass nit modRNA gefüllte LNPs eine unsymmetrische Struktur haben.
Die vier verschiedenen LNP Forumulierungen (DOPE, DSPC, DOPS, or DOTAP) wurden daraufhin untersucht, welche Proteine an sie binden.
In den COVID-Produkten und Onpattro wird DSPC eingesetzt, jedoch keines der anderen drei Phospholipide.
Über alle vier LNP-Formulierungen hinweg, die jeweils in zwei unabhängigen Synthesen hergestellt und in drei separaten LC-MS/MS-Durchläufen pro Charge analysiert wurden, identifizierten wir insgesamt 124 Proteine:
1 in DOPE,
7 in DOPS,
61 in DOTAP und
71 in DSPC.
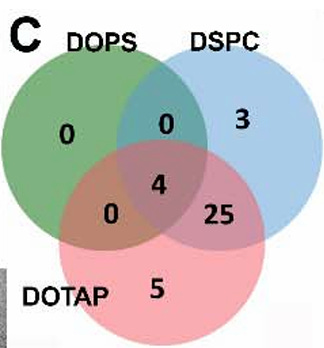
Davon waren 37 Proteine in allen Replikaten vorhanden, mit folgender Verteilung:
DOPE (0 Proteine),
DOPS (4 Proteine),
DOTAP (34 Proteine) und
DSPC (32 Proteine).
Um den Einfluss der PEG-Konzentration zu bewerten, wurden DOPE-LNPs mit 0 %, 1,5 % und 2,5 % PEG-Beschichtung verglichen. Trotz einer deutlichen Aggregation, die bei den mit 0 % und 1,5 % PEG beschichteten LNPs beobachtet wurde, wurden keine signifikanten Unterschiede in der Anzahl oder Identität der assoziierten Proteine zwischen den verschiedenen Formulierungen festgestellt.
Verwendet wird in den klinisch eingesetzten LNPs exakt das Lipid, das am meisten Proteine an das LNP bindet. Vielleicht einer der Gründe, warum man DSPC und nicht die anderen Phospholipide einsetzt?
Zumindest die Menge des PEGylierten Lipids scheint keinen Einfluss darauf zu nehmen, welche Proteine an das LNP binden.
C) Venn-Diagramm, das überlappende Proteingruppen darstellt, die in allen Proben identifiziert wurden. Die in dieser Analyse berücksichtigten Proteingruppen enthielten gültige LFQ-Intensitätswerte (Label-Free Quantification). Überschneidungen weisen auf Proteine hin, die häufig zwischen NPs nachgewiesen werden und gemeinsame und einzigartige Komponenten der Proteinkorona-Zusammensetzung widerspiegeln.
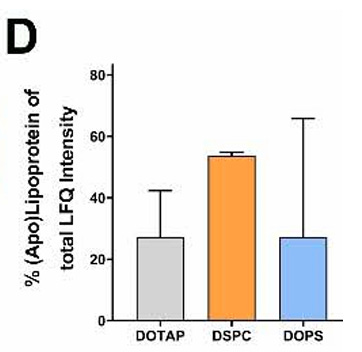
D) Prozentualer Anteil von (Apo-)Lipoproteinen an der gesamten LFQ-Intensität in jeder Probe. Das Balkendiagramm zeigt den relativen Anteil von (Apo-)Lipoproteinen im Vergleich zu den insgesamt nachgewiesenen Proteinen in LNPs (n = 6 für jeden LNP-Typ).
ApoE ist der Grund, warum LNPs direkt in die Leber gehen, der Grund, warum Onpattro so gut funktioniert. ApoE ist eine Art Adressetikett, das dem Körper sagt, dass das Lipid in die Leber soll.
Es ist bekannt, dass Lipoproteine und EVs in verschiedenen Bioflüssigkeiten funktionelle Komplexe bilden.Wechselwirkungen zwischen mehreren Arten von (Apo-)Lipoproteinen wie ApoE (in Chylomikronen, High-Density-Lipoprotein (HDL) und VLDL), ApoM (in HDL) sowie ApoCII und ApoCI (in Chylomikronen, HDL und VLDL) mit lipidbasierten Nanopartikeln wie EVs, LNPs, Doxil und LIPO sind gut dokumentiert. Diese Fusion trägt zusammen mit den potenziellen Proteininteraktionen mit Blebs wahrscheinlich zur effizienten Aufnahme von LNPs durch Leberhepatocyten bei, vermittelt durch die Interaktion von ApoE-reichen Lipoproteinen mit der Nanopartikeloberfläche nach intravenöser Verabreichung.
[…]
In Übereinstimmung mit dem letztgenannten Mechanismus adsorbiert ApoE an zirkulierende LNPs, reorganisiert die LNP-Architektur und vermittelt die Aufnahme durch Hepatozyten über LDL-Rezeptoren, eine entscheidende Determinante für die siRNA/mRNA-Abgabe.
[…]
Frühere Studien haben gezeigt, dass sich Plasmaproteine, insbesondere Apolipoproteine wie ApoE, nach Plasmaexposition auf LNP-Oberflächen anreichern und die zelluläre Aufnahme von LNP, den intrazellulären Transport und die Effizienz der mRNA-Transfektion erheblich beeinflussen.
Und erneut, DSPC, das verwendete Phospholipid, bindet von den vier getesteten Phospholipide am meisten (Apo-)Lipoproteine. Das ist Absicht.
Anstatt diskrete periphere Hüllen zu bilden, die als Barrieren wirken könnten, verbinden sich Proteine durch Lipoprotein-Fusion und direkte Membranintegration mit LNPs. Dieser fusionsbasierte Mechanismus hat mehrere funktionelle Auswirkungen.
Erstens verändert die Lipoprotein-Fusion direkt die Zusammensetzung und die physikalischen Eigenschaften der LNP-Membran, was sich möglicherweise auf die Fluidität, Stabilität und Fusionsfähigkeit mit endosomalen Membranen auswirkt. Dies könnte erklären, warum die Proteinassoziation nicht nur die Aufnahme, sondern auch nachgelagerte Ereignisse wie den endosomalen Entzug beeinflusst.
Zweitens werden mit Apolipoprotein angereicherte LNPs von Lipoproteinrezeptoren (z. B. LDL-Rezeptoren für ApoE-tragende Partikel) erkannt, was einen molekularen Mechanismus für den häufig bei intravenös verabreichten LNPs beobachteten Lebertropismus darstellt. Unsere Beobachtung, dass die Lipoprotein-Fusion bei allen LNP-Formulierungen konsistent auftritt, stützt dies als allgemeinen Mechanismus der proteinvermittelten Zielfindung.
Drittens könnte die dynamische Natur der Membranfusion im Gegensatz zur statischen Hüllenbildung den Proteintausch und die Umgestaltung während der Zirkulation ermöglichen. Dies könnte möglicherweise die in kinetischen Studien beobachtete Entwicklung der Corona-Zusammensetzung erklären. Der Fusionsmechanismus lässt auch Möglichkeiten für ein rationales Design erkennen: Anstatt die Proteinadsorption zu verhindern (das typische Ziel der PEGylierung), könnten LNP-Formulierungen so optimiert werden, dass sie spezifische Lipoprotein-Wechselwirkungen begünstigen, die das Targeting auf gewünschte Gewebe verbessern.
“Der Fusionsmechanismus lässt auch Möglichkeiten für ein rationales Design erkennen: Anstatt die Proteinadsorption zu verhindern (das typische Ziel der PEGylierung), könnten LNP-Formulierungen so optimiert werden, dass sie spezifische Lipoprotein-Wechselwirkungen begünstigen, die das Targeting auf gewünschte Gewebe verbessern.”
Genau das ist bereits geschehen. Man nimmt aus gutem Grund DSPC exakt weil es ApoE bindet und das LPN somit über LDL-Rezeptoren an praktisch alle Zellen andocken kann. Das scheint den Autoren jedoch nicht klar zu sein, denn sie schreiben:
Dies erfordert dann die Entwicklung spezifischer Lipoprotein-Koronen für die gezielte Abgabe, was durch Modulation der LNP-Lipidzusammensetzung oder Einbau von Liganden wie ApoE-Mimetika erreicht werden kann.
Wozu diesen Aufwand betreiben? Es reicht DSPC zu nehmen, das macht das schon ganz von alleine, wie man bei Onpattro gezeigt hat.
Unsere mechanistischen Erkenntnisse definieren bestehende Designprinzipien neu: Anstatt PEGylierung und zelluläre Aufnahme empirisch gegeneinander abzuwägen, können Formulierungen nun rational so gestaltet werden, dass sie bestimmte Lipoprotein-Fusionsvorgänge durch koordinierte Optimierung des PEG-Gehalts, der Lipidzusammensetzung (Helfer, ionisierbare Lipide) und der Oberflächenladung modulieren. Schließlich beeinflusst dies die Stabilität und die Freisetzung der Fracht: Die enge Verbindung der Lipoprotein-Fusion wirkt sich auf die LNP-Stabilität, die Membranintegrität und die Freisetzung der eingekapselten Fracht aus. Daher ist es von entscheidender Bedeutung, LNPs zu entwickeln, die eine produktive Fusion für die Endosomenflucht oder die Nutzlastabgabe nutzen, und neue In-vitro- und In-vivo-Assays zu entwickeln, um diese spezifischen Fusions- und Bleb-Wechselwirkungen zu optimieren.
Sollte man sich nicht lieber an natürlichen EVs orientieren? Natürliche EV bilden keine Proteincorona aus, dementsprechend sollte man vorzugsweise DOPE als Phospholipid nehmen, wenn man denn diese Schwachsinnstechnologie weiterverfolgen möchte.
Das Fazit der Autoren:
Zusammenfassend stellen unsere Ergebnisse die vorherrschende Annahme in Frage, dass weiche, lipidbasierte Nanopartikel wie LNPs eine traditionelle Proteinkorona bilden, die als diskrete, adsorbierte Proteinhülle entlang der Oberfläche härterer Nanopartikel wie Polystyrol-Nanopartikeln beobachtet wurde. Stattdessen liefern wir direkte strukturelle Beweise dafür, dass LNPs durch Lipoprotein-Fusion oder Wechselwirkungen mit Bleb-Strukturen mit Plasmaproteinen in Kontakt treten, was zu hybriden Anordnungen führt, in denen Lipoproteine mit der LNP-Oberfläche verschmelzen und sich in diese einfügen. Während eine herkömmliche Proteinkorona die Nanopartikeloberfläche passiv umhüllt und sich dynamisch desorbieren oder neu anordnen kann, impliziert diese Lipoprotein-Fusion eine stabile, kompositorische Transformation der lipidbasierten Nanopartikel. Folglich wird die biologische Identität der LNP nicht nur durch Serumkomponenten maskiert, sondern durch die Einbindung endogener Lipoproteine grundlegend neu definiert. Dadurch können LNPs effektiv in endogene Lipidtransportprozesse in vivo eingebettet werden, was eine Bindung an native Lipidtransport- und rezeptorvermittelte Aufnahmewege ermöglicht und gleichzeitig die Immunerkennung potenziell verringert.
Mein Fazit:
Ob die Proteine nun fest an Partikel binden wie an Gold ohne zu integrieren oder fest an LNP binden indem sie integrieren, das Endergebnis ist letztendlich das Gleiche: Es bindet fest. Mit ist egal ob es geschraubt, gedübelt oder geklebt ist, solange es fest hält.
Für mich ist die Haupterkenntnis dieses Preprints, dass man DOPE hätte nehmen sollen, damit sich keine Proteincorona ausbildet, wie bei natürlichen EVs und statt dessen DSPC nimmt, damit sich eine möglichst starke APO(E) Corona ausbildet, die man dann gleichzeitig den Zulassungsbehörden als Mechanismus verschweigt. Ohne diese Proteincorona mit Apolipoproteinen würden die LNPs möglicherweise ganz anders im Körper agieren.
Wie dieses Ergebnis den Autoren entgehen konnte, ist mir schleierhaft.
Vitriol, D. V. (2025b, April 18). LNPs und ihre Protein-Corona. DrBine’s Newsletter.
Vitriol, D. V. (2023b, October 11). Kationische Nanolipide: was die Hersteller den Behörden bewusst verschwiegen haben. DrBine’s Newsletter.
Sheibani S, Basu K, Farnudi A, Ashkarran A, Ichikawa M, Presley JF, Bui KH, Ejtehadi MR, Vali H, Mahmoudi M. Nanoscale characterization of the biomolecular corona by cryo-electron microscopy, cryo-electron tomography, and image simulation. Nat Commun. 2021 Jan 25;12(1):573. doi: 10.1038/s41467-020-20884-9. PMID: 33495475; PMCID: PMC7835367. https://pubmed.ncbi.nlm.nih.gov/33495475/
Nitipan, S. (2024). Advances in microparticle bombardment for genetic transformation, drug delivery and materials science. Longdom. https://doi.org/10.35248/2311-3278.24.12.280 https://www.longdom.org/open-access/advances-in-microparticle-bombardment-for-genetic-transformation-drug-delivery-and-materials-science-1101768.html
Szebeni J, Kiss B, Bozó T, Turjeman K, Levi-Kalisman Y, Barenholz Y, Kellermayer M. Insights into the Structure of Comirnaty Covid-19 Vaccine: A Theory on Soft, Partially Bilayer-Covered Nanoparticles with Hydrogen Bond-Stabilized mRNA-Lipid Complexes. ACS Nano. 2023 Jul 25;17(14):13147-13157. doi: 10.1021/acsnano.2c11904. Epub 2023 Jul 7. PMID: 37417667; PMCID: PMC10373524. https://pubmed.ncbi.nlm.nih.gov/37417667/
Suzuki Y, Ishihara H. Difference in the lipid nanoparticle technology employed in three approved siRNA (Patisiran) and mRNA (COVID-19 vaccine) drugs. Drug Metab Pharmacokinet. 2021 Dec;41:100424. doi: 10.1016/j.dmpk.2021.100424. Epub 2021 Oct 10. PMID: 34757287; PMCID: PMC8502116. https://pubmed.ncbi.nlm.nih.gov/34757287/
🔗 Quelle: https://drbine.substack.com/p/dspc-bindet-die-meisten-proteine