VITT (vaccine-induced immune thrombotic thrombocytopenia) blubberte medizinisch erst seit den AstraZeneca COVID-Plörren in der Literatur hoch ist aber weder neu, noch auf das AstraZeneca Produkt beschränkt.
Wir haben es hier mit den Phänomen zu tun, dass ein altbekannter Mechanismus einen neuen Namen bekommt, um ihn zu mystifizieren und die Suche nach Literatur zu erschweren.
Ich würde sagen, VITT ist eine ganz normale, klassische Immunthrombose, wie das Immunsystem sie lostritt, um Viren einzumauern und so von einer Verbreitung im Körper abzuhalten.
Rein mechanische Barriere sozusagen. Wenn das Virus durch das verklumpte Blut nicht mehr durch und aus dem Blutklumpen nicht raus kommt, ist das Problem unter Kontrolle. Das ist wahrlich nicht schwer zu verstehen.
Das gibt es auch bei anderen Viren wie Influenza und anderen Impfungen, z. Bsp. bei Grippeimpfungen. Bei klassischen Influenzaimpfstoffen sind die Viren bereits tot und dennoch kann es zu Thrombosen kommen. Es wurden auch Fälle von Thrombocytopenie nach MMR-Impfung oder Tetanus-Impfung berichtet. Es gibt solche Berichte sogar nach Impfung von Hunden, der Immunmechanismus ist also speziesübergreifend. Thrombocytopenie nach Impfung generell ist nicht neu.
Das Ganze hat was mit der Größe und Ladung der Virenpartikel zu tun.
VITT und die diversen Thrombosen nach Impfungen sind nicht direkt identisch. VITT ist eine spezielle Art der Thrombose. Durch die Fixierung auf die VITT-Variante klammert man das generell bekannte Thrombose Problem nach Impfungen oder viralen Infekten aus und konzentriert sich auf diese spezielle Unterart, die man angeblich nicht kennen konnte.
Auffällig ist die Artikelmenge im Zeitverlauf auf pubmed für die Anfrage (Thrombocytopenia[Title]) AND (vaccination[Title])
Sicherlich Zufall.
Natürlich ist es bei den COVID-Plörren ein klein wenig komplexer als bei einer Influenza-Impfung, denn neben dem Virus selbst gibt es noch das Produkt, das nach der Transfektion der Zellen produziert wird: das Spike-Protein. ABER, SPOILER: Das Spike war nicht das Problem, die Plattform war das Problem! DAS ist eine ganz andere Hausnummer.
Die Grundlagen zu Astras Heilspritze habe ich hier zusammengestellt:
Am 12. Februar erschien mal wieder ein Artikel der diesmal nun wirklich geklärt haben will, warum es bei AstraZenecas Heilspritze gegen COVID zu bedauerlichen Zwischenfällen in Form von VITT kam.
Man beachte einige der Autoren:
Mein Lieblingsautor: Lars Kaderali
Lars war Berater des Kanzleramts unter dem Bundesolaf (auf der Liste Nr. 9)
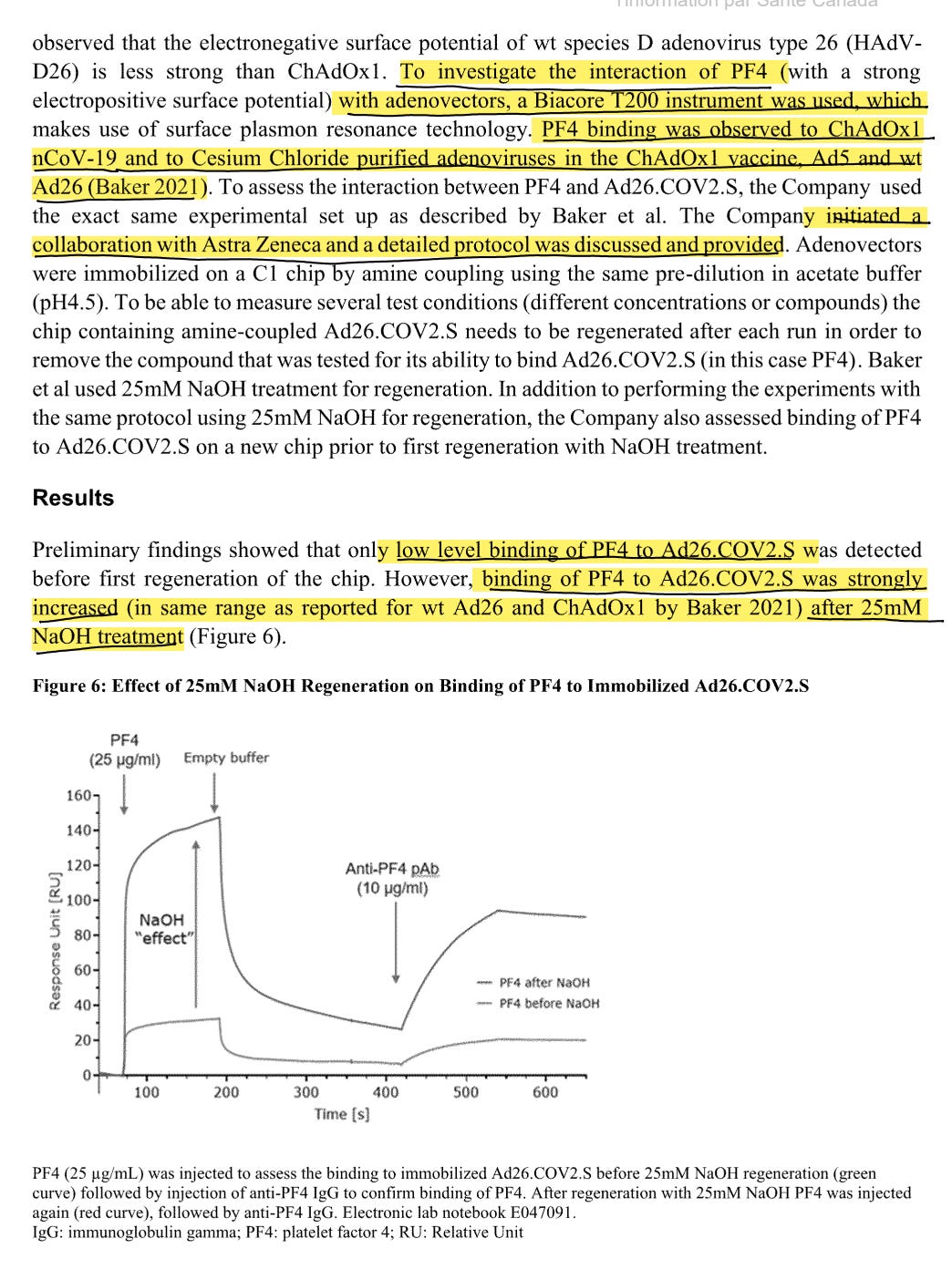
Das Friedrich Löffler Institut ist involviert und J&J. Das ist nicht überraschend. J&J hatte Astra Proben, um das Problem zu erforschen, die Daten liegen teils in Rohform vor.
Sowohl Astras als auch J&Js Produkt binden an PF4, wenn sie denaturiert werden.
Astra ist aber auffällig abwesend unter den Autoren dieser Publikation.
Die impfstoffinduzierte immunologische Thrombozytopenie und Thrombose (VITT) ist eine seltene prothrombotische Komplikation, die nach einer Impfung mit einem adenoviralen Vektor gegen die Coronavirus-Krankheit 2019 auftritt; in seltenen Fällen kann sie auch nach einer natürlichen Adenovirus-Infektion auftreten. VITT wird durch Thrombozyten-aktivierende Antikörper gegen das stark kationische Protein Thrombozytenfaktor 4 (PF4) vermittelt. Der zugrunde liegende Antigenauslöser und die Immunpathogenese sind nach wie vor unbekannt.
Kleine Korrektur: Die impfstoffinduzierte immunologische Thrombozytopenie tritt praktisch bei jeder Art viralem Impfstoff auf, das ist nicht neu, das war schon immer so. Leider haben die Hersteller vergessen, das in ihren Beipackzettel zu schreiben.
in seltenen Fällen kann sie auch nach einer natürlichen Adenovirus-Infektion auftreten
Im Text steht das noch ein wenig genauer:
In seltenen Fällen tritt VITT auch nach einer natürlichen Adenovirus-Infektion auf, was darauf hindeutet, dass eine hochkonservierte Struktur innerhalb verschiedener Adenovirus-Subtypen die Anti-PF4-Reaktion auslösen kann.
Und weil das schon bei natürlichen Adenovirus-Infektionen passieren kann, spritzt man diese Art Viren direkt ins Blut und behauptet dann vor Gericht, dass es gar nicht sein kann, dass es hierbei zu einer Thrombozytopenie kommen könnte. Das Problem ist auch nicht mit einer anderen Adenovirusvariante erledigt, es ist die komplette Gruppe der Adenoviren. Das Adenovirus-Core-Protein VII (pVII) ist eines der am stärksten konservierten Proteine innerhalb der Adenoviridae-Familie. Damit ist die Plattform tot, würde ich sagen.
Diese Annahme wird durch die einheitliche Struktur der Anti-PF4-Antikörper bestätigt, die bei der VITT-Immunantwort gebildet werden. Anti-PF4-Antikörper, die aus dem Serum von Patienten mit VITT nach einer Impfung oder einer natürlichen Adenovirusinfektion isoliert werden, sind in der Regel monoklonal oder oligoklonal.
Das heißt, es gibt nur eine Variante oder sehr wenige Varianten der Antikörper, die das Problem verursachen. Das Problem ist immunologisch eindeutig definiert und nicht sonderlich diffus.
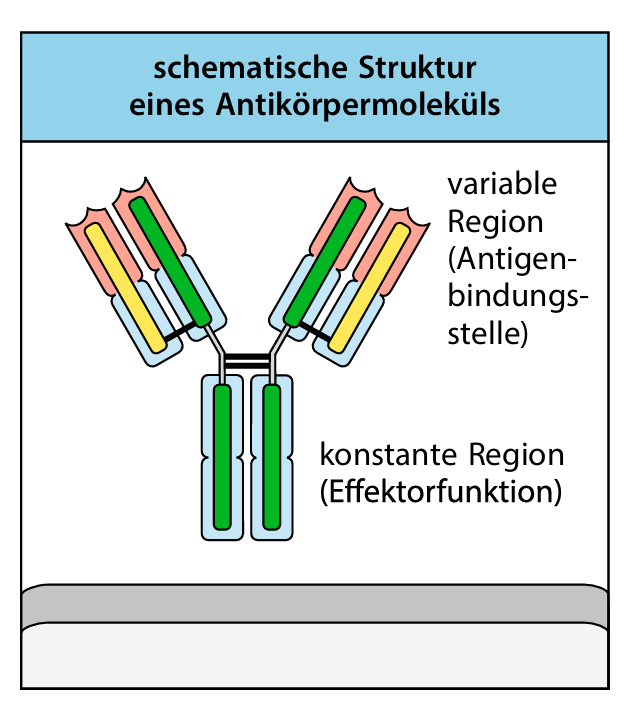
Kurzer Exkurs in den Aufbau eines Antikörpers aus dem Lehrbuch Janeway Biologie 9. Auflage S. 17
Der “Stamm” in blau ist die konstante Region, die den Antikörpertyp definiert, z. Bsp. IgG, IgM, IgA.
Oben, die “Arme” sind variable und der Teil, der für die eigentliche Erkennung zuständig ist.
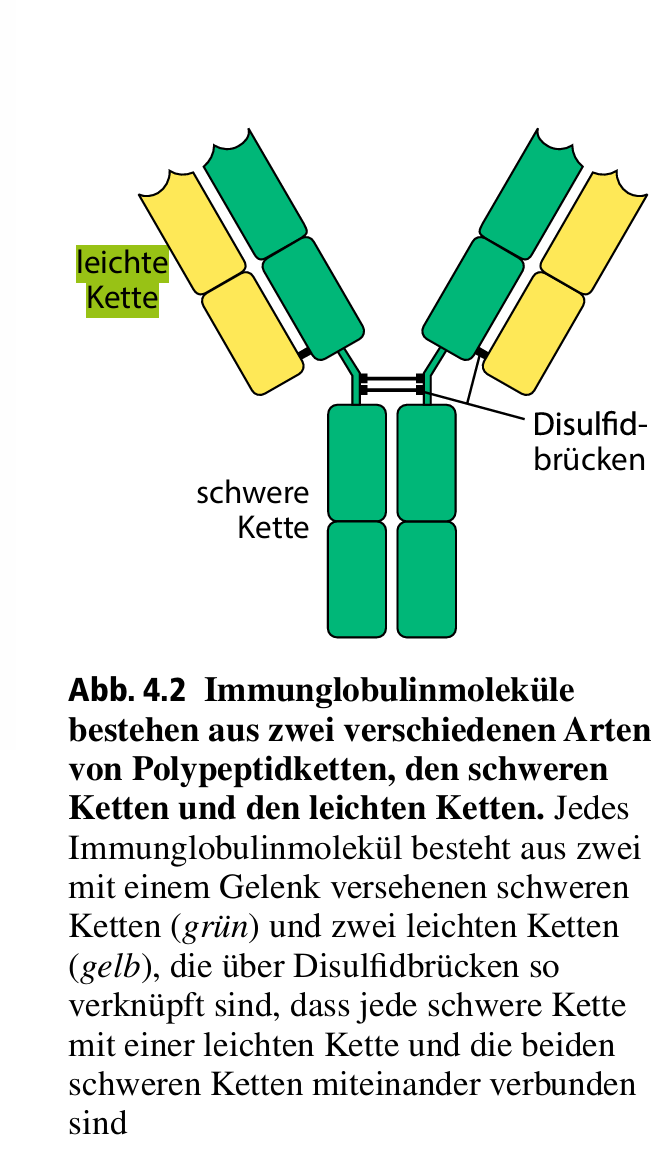
Die “leichte Kette” ist eine historische Bezeichnung, die etwas mit Zentrifugation zu tun hat. In der 9. Auflage des Janeway auf Seite 180.
Die leichte Kette besteht teilweise aus “Stamm” und variabler Region, aber nur die halbe variable Region.
Diese Antikörper haben leichte und schwere Ketten mit molekularen Fingerabdrücken, die bei Patienten nahezu identisch („stereotyp“) sind. Diese Eigenschaft ermöglichte es uns, rekombinante Versionen dieser Antikörper zu erzeugen, wodurch detaillierte In-vitro- und In-vivo-Studien möglich wurden.
Das Problem ist also immunologisch eindeutig und bei allen Patienten identisch. Es ist also die Virenhülle, die das Problem ist, der Vektor, die Plattform selbst, nicht das Spike-Gen. DAS ist wichtig für Anwälte. Mit dieser Argumentation ist man weg vom bösen, bösen Spike-Protein. Die Plattformtechnologie selbst ist bereits das Problem. Egal, was man an “Impfgen” da reinpacken würde, es würde zum gleichen Problem kommen. DAS hätte man prüfen müssen, bevor man so eine Plattform zum Einsatz bringt, besonders, wenn das Problem bereist von Infektionen mit wilden Adenoviren bekannt ist.
Da hohe Titer von Anti-PF4-Antikörpern bereits 5 Tage nach der Impfung auftreten, ist es wahrscheinlich, dass sie als Teil einer sekundären (verstärkten) Immunantwort gebildet werden. Da die Fingerabdrücke der Anti-PF4-Antikörper nach der Impfung praktisch identisch mit denen nach einer Adenovirus-Infektion sind, stellten wir die Hypothese auf, dass Anti-PF4-Antikörper wahrscheinlich aus einer Gedächtnisantwort gegen Adenoviren hervorgehen.
Oups… Menschen, die schon mal mit Adenoviren Kontakt hatten, also alle Menschen, könnten diese Antikörper also schon vor der Injektion gehabt haben? Hätte man das vielleicht vorher testen sollen bevor man ihnen das sichere Produkt verabreicht?
Hier identifizieren wir das auslösende Antigen, das VITT induziert, als eine kreuzreaktive Determinante, die PF4 und dem hochkonservierten, reichlich vorhandenen Adenovirus-Kernprotein VII (pVII) gemeinsam ist, das an das virale Genom bindet und dessen Transport in den Zellkern vermittelt.
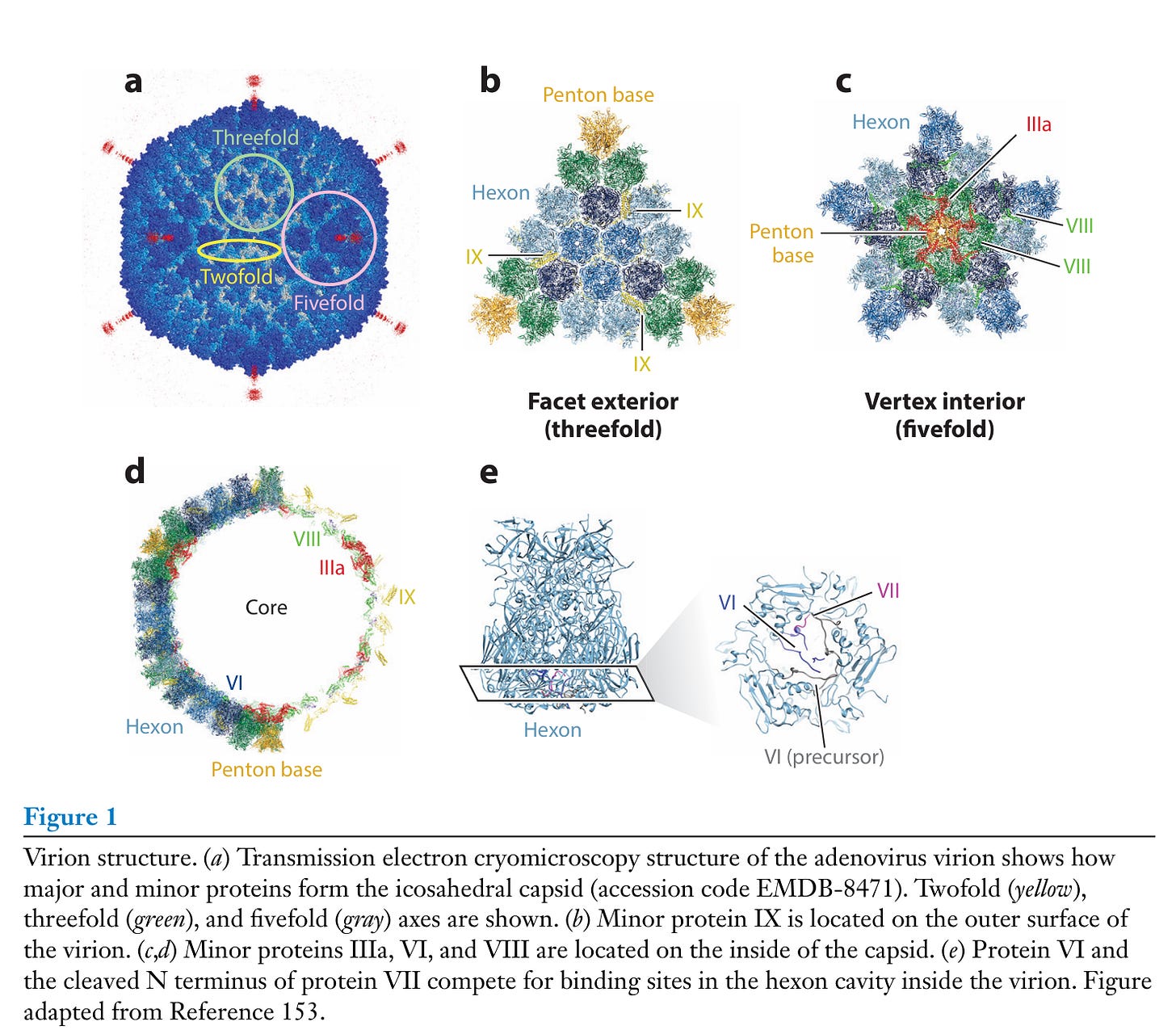
Der Verursacher ist das Kernprotein VII im Bild unten unter e
“Das Genom besteht aus etwa 36 kbp doppelsträngiger DNA und wird von den Kernproteinen V, VII, μ, IVa2, dem Terminalprotein und der viralen Protease begleitet.”
Scheint mir so, als wenn man das Kernprotein VII nicht entfernen kann und somit die Plattform tot ist, denn das ist Teil der Hülle und super wichtig und das Protein mit eines der konserviertesten der ganzen Adenovirenfamilie. Das sind aus gutem biologischen Grund sehr konstante Regionen, weil Mutationen in diesen Bereichen dem Virus nicht zuträglich sind.
Dieses Protein weist sowohl hinsichtlich seiner Ladung als auch hinsichtlich seiner Eigenschaften bei der Bindung an natürliche Liganden wie DNA Ähnlichkeiten mit PF4 auf.
Daher trat das Problem in den oben gezeigten J&J Rohdaten nach Denaturierung des Virus auf!
Die Autoren isolierten Antikörper aus VITT Patienten, analysierten diese und bauten die Antikörper mit den üblichen Methoden nach.
ChAdOx1 ist der Astra Adenovirusvektor.
Ad26.COV2 ist der J&J Adenovirusvektor.
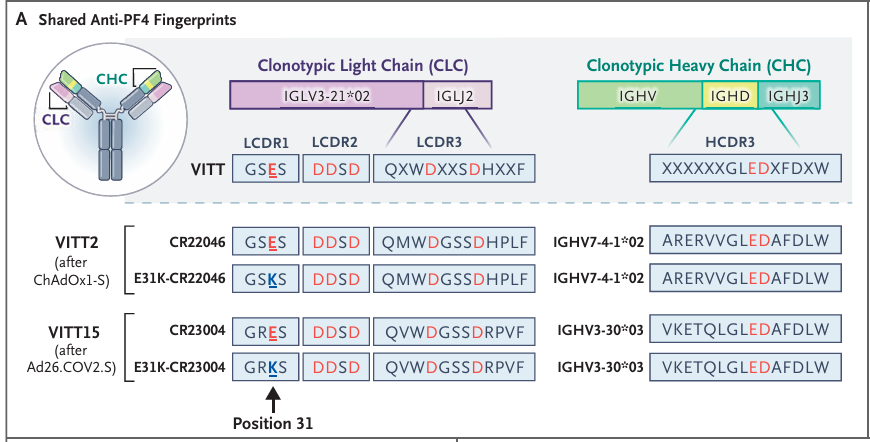
Abbildung A zeigt die Anti-Plättchenfaktor-4 (PF4)-Fingerabdrücke der in dieser Studie verwendeten Antikörper. Der obere Teil von Panel A zeigt konsensuelle Anti-PF4-Antikörper-Fingerabdrücke von Patienten mit klassischer impfstoffinduzierter Thrombozytopenie und Thrombose (VITT), die durch eine einzelne Immunglobulin-Lambda-Variable 3-21*02 (IGLV3-21*02) Leichtkette in Verbindung mit einer einzelnen Schwerkette gekennzeichnet sind, die ein gemeinsames ED-Motiv in der dritten komplementaritätsbestimmenden Region der Schwerkette (HCDR3) exprimiert. Der untere Teil des Panels (unterhalb der gestrichelten Linie) zeigt die rekombinanten Anti-PF4-Antikörper-Fingerabdrücke von zwei Patienten mit VITT nach Impfung mit ChAdOx1-S oder Ad26.COV2.S. Die obere Sequenz zeigt den Fingerabdruck der Antikörper, wie er aus dem Patientenserum gewonnen wurde. Ihre Anti-PF4-Signaturen sind bemerkenswert konserviert; saure (negativ geladene) Reste sind rot dargestellt. Alle Antikörper haben ein stark saures DDSD-Motiv, eine Mutation, die zu einer Veränderung von basischem Lysin zu saurer Glutaminsäure an Position 3124 in der komplementaritätsbestimmenden Region 1 der leichten Kette (LCDR1) führt, und identische LCDR3-Längen mit zwei gleichmäßig beabstandeten Asparaginsäureresten in Kombination mit einem Immunglobulin-Lambda-Joining-2 (IGLJ2). Ihre schweren Ketten haben identische HCDR3-Längen (ein Marker für klonale Gemeinsamkeit) mit einem sauren ED-Motiv, das mit einem Immunglobulin Heavy Joining 3 (IGHJ3) neu angeordnet ist. Anti-PF4-Antikörper bestehen aus unterschiedlichen Immunglobulin Heavy Variable (IGHV)-Unterfamilien. Die untere Sequenz zeigt den Fingerabdruck der rekombinanten Antikörper, bei denen die somatische Hypermutation der Glutaminsäure an Position 31 von LCDR1 zurückmutiert wurde zum Keimbahn-Lysin (E31K-CR22046 und E31K-CR23004). Die Daten für Patient VITT2 wurden bereits zuvor veröffentlicht.
“Anti-PF4-Antikörper bestehen aus unterschiedlichen Immunglobulin Heavy Variable (IGHV)-Unterfamilien.” bedeutet, dass das Problem auch beim Typenwechsel des Antikörpers (IgG, IgM, IgA…) erhalten bleibt. Der Typ des Antikörpers ist egal, die variable Region ist das Problem.
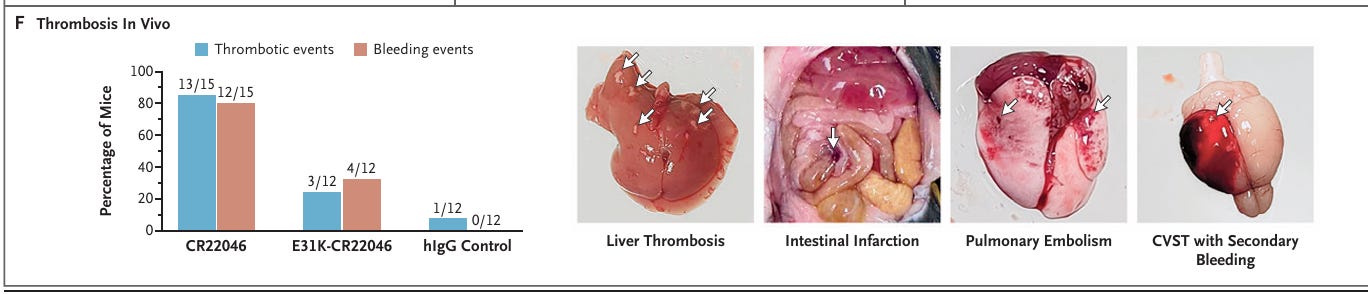
Man hat nun Mäusen die nachgebauten Antikörper intravenös gespritzt und geschaut, was passiert.
Abbildung F zeigt den Prozentsatz der Mäuse mit makroskopischer Thrombose oder Blutung sowie repräsentative Bilder von Leber, Darm, Lunge und Gehirn. Von den 15 Mäusen, die CR22046 erhielten, hatten 13 (87 %) thrombotische Komplikationen (8 Mäuse hatten Thrombosen an mehreren Stellen). Die sekundäre Hirnblutung wurde durch eine Thrombose der Hirnvenen verursacht. Von den 12 Mäusen, die die zurückmutierte Variante E31K-CR22046 erhielten, hatten nur 3 thrombotische Komplikationen (1 Maus hatte multiple Thrombosen in der Leber und den Hirnvenen, 2 hatten eine Lungenembolie). CVST steht für Thrombose der Hirnvenen.
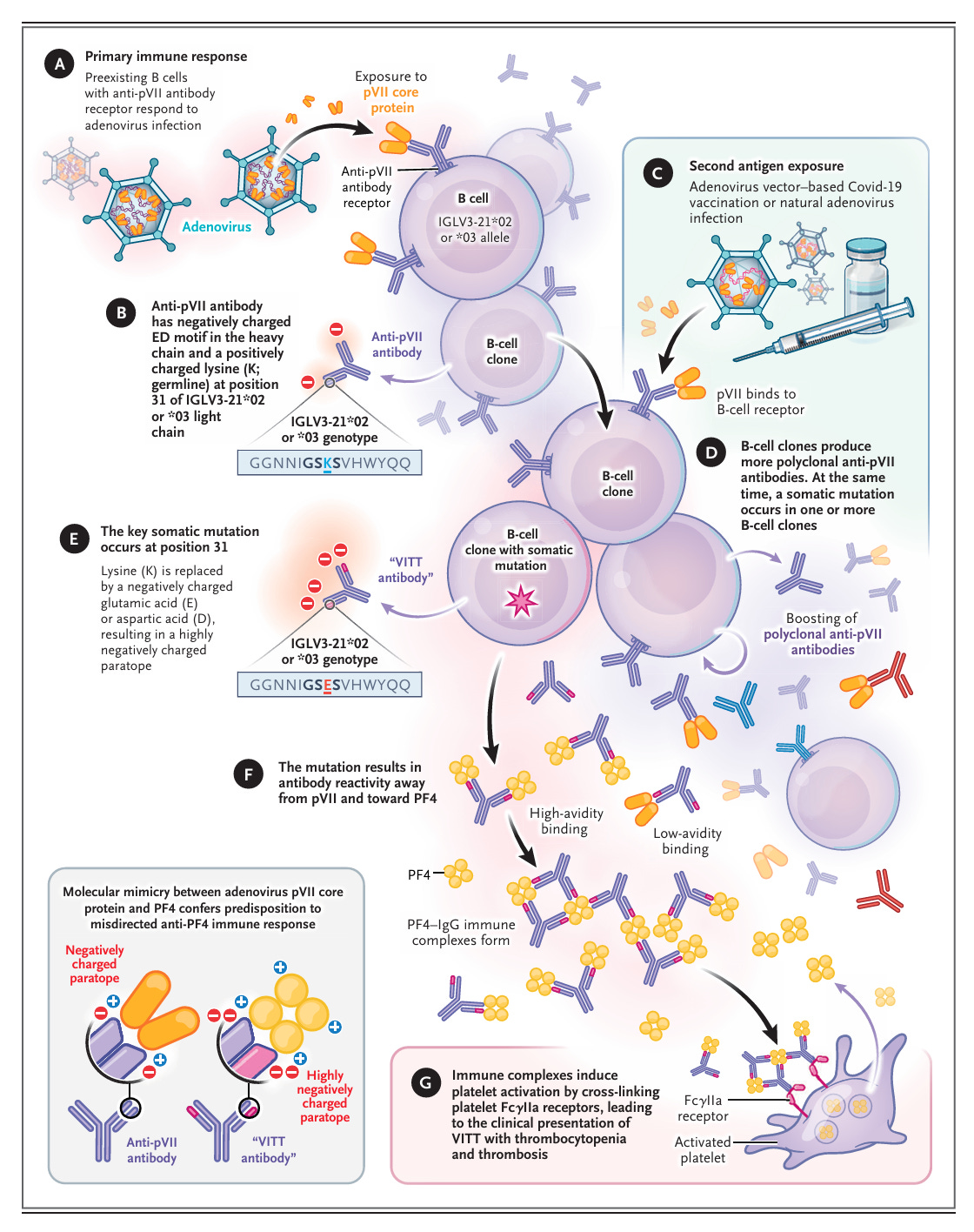
Immunpathophysiologie von VITT. Die molekulare Mimikry zwischen dem Adenovirus-Kernprotein pVII und PF4 in Kombination mit einer spezifischen somatischen Hypermutation, die eine Anti-pVII-Immunantwort in eine fehlgeleitete Anti-PF4-Immunantwort umwandelt, ist ein grundlegender pathobiologischer Mechanismus von VITT. Die primäre Antigenexposition tritt auf, wenn ein Patient mit der genetischen Veranlagung durch das Allel IGLV3-21*02 oder *03, das die hypervariable Region der leichten Kette des Immunglobulins kodiert, während einer Adenovirusinfektion mit zahlreichen viralen Proteinen, darunter pVII, in Kontakt kommt. Die resultierenden Anti-pVII-Antikörper haben die Keimbahnsequenz des Genotyps IGLV3-21*02 oder *03 mit einem positiv geladenen Lysin an Position 31 und einem negativ geladenen ED-Bindungsmotiv der hypervariablen Region der schweren Kette. Die zweite Antigenexposition erfolgt zum Zeitpunkt der adenovirusvektorbasierten Covid-19-Impfung (oder einer natürlichen Adenovirusinfektion [nicht gezeigt]). Der Impfstoff enthält Adenovirus-Proteine, darunter pVII5; pVII bindet an den bereits vorhandenen B-Zell-Rezeptor und steigert die Antikörperproduktion. Die Verstärkung bewirkt, dass mehrere B-Zell-Klone polyklonale Anti-pVII-Antikörper produzieren. Gleichzeitig tritt eine seltene somatische Mutation (oder Mutationen) in einem oder mehreren B-Zell-Klonen auf (alternativ expandiert ein bereits vorhandener Anti-pVII-Antikörperklon mit geringer Konzentration, der die K31E-Mutation trägt, nach der Impfung schnell [nicht gezeigt]). Die entscheidende somatische Mutation tritt an Position 31 auf – ein positiv geladenes Lysin wird durch eine negativ geladene Glutaminsäure oder Asparaginsäure ersetzt, was zu einem stark negativ geladenen Paratop führt. Diese Mutation führt dazu, dass die Antikörper nicht mehr auf pVII, sondern auf PF4 reagieren. Diese kreuzreagierenden Anti-PF4-Antikörper („VITT-Antikörper“) binden nun mit hoher Avidität an PF4 und bilden große PF4-IgG-Immunkomplexe, während die Bindung an pVII weiterhin eine geringe Avidität aufweist. Diese Immunkomplexe induzieren die Thrombozytenaktivierung durch Vernetzung der Thrombozyten-FcγIIa-Rezeptoren, was zu dem typischen klinischen Bild von VITT mit Thrombozytopenie und Thrombosen an ungewöhnlichen Stellen führt. Dieses Modell erklärt die klinischen Merkmale von VITT, zu denen die offensichtliche sekundäre (verstärkte) Immunantwort mit explosivem Auftreten von IgG-Anti-PF4-Antikörpern bereits 5 Tage nach der Impfung gehört; Die sehr geringe Häufigkeit von VITT (viel seltener als Heparin-induzierte Thrombozytopenie) ist auf die Notwendigkeit einer spezifischen somatischen Mutation in einer B-Zelle zurückzuführen, die für ein eingeschränktes Epitop (widerspiegelt durch die Sequenz RYARAKSRRRRIARR) auf dem Hintergrund eines spezifischen IGLV-Haplotyps spezifisch ist.
Das heißt, gegen Sars-COV2 immune Menschen und jene mit einer Kreuzimmunität durch andere Adenoviren (also grob 80% der Bevölkerung) hätten nie, nie, nimmer, nicht mit einem Adenovirusimpfstoff geimpft werden dürfen ohne vorher zu kontrollieren, ob sie nicht eine genetischen Veranlagung durch das Allel IGLV3-21*02 oder *03 haben.
Die Ergebnisse dieser Studie sind relevant für Strategien zur Erhöhung der Sicherheit von Impfstoffen auf Basis von Adenovirus-Vektoren. Diese Impfplattform hat große Vorteile – beispielsweise die Erschwinglichkeit für Gesundheitssysteme in Ländern mit niedrigem und mittlerem Einkommen und die Möglichkeit einer schnellen Bereitstellung von Impfstoffen im Falle einer neuen Pandemie. Die Identifizierung der molekularen Mimikry zwischen pVII und PF4 als grundlegender vorgelagerter Immunmechanismus von VITT könnte nun den Weg für die Entwicklung sicherer adenoviraler Vektorimpfstoffe ebnen – Impfstoffe, in denen pVII durch Analoga ersetzt wird, die keine B-Zellen aktivieren, die für das Epitop auf pVII spezifisch sind, das strukturelle Ähnlichkeiten mit PF4 aufweist.
Das heißt, ALLE aktuellen Adenovirusplattformen sind tot, weil man vorher schauen muss, ob der Patienten 1. nicht bereits Kontakt zu Adenoviren hatte (was praktisch alle Menschen hatten) und 2. dieser Mensch darf einen bestimmten Genotyp nicht haben. Das bedeutet sequenzieren und ist teurer als die Spritze.
Fazit:
Allein dass das Thromboseproblem von normalen wildtypischen Infektionen bekannt war, hätte den Einsatz von der Logik her verbieten müssen.
Kein Wunder, dass die Jubelmeldungen der Mainstreampresse zu diesen deutschen Forschungsergebnissen auf sich warten lassen. So wie ich das Paper verstehe, hätte niemand mit Vaxzevria oder JCOVDEN injiziert werden dürften ohne dass vorher eine genetische Unbedenklichkeit vorgelegen hätte. Das gilt auch für ALLE zukünftigen Impfungen auf diesen beiden Plattformen. Damit ist die Plattform von JJ und AZ erst mal Geschichte und kann zu den Akten gelegt werden.
Da der Übeltäter das mit am konservierteste Protein der Adenovirenfamilie ist, ist es praktisch unmöglich, das Problem zu lösen, denn das Protein ist aus gutem Grund extrem konserviert.
Antoniak S. The coagulation system in host defense. Res Pract Thromb Haemost. 2018 May 24;2(3):549-557. doi: 10.1002/rth2.12109. PMID: 30046760; PMCID: PMC6046589. https://pmc.ncbi.nlm.nih.gov/articles/PMC6046589/
De Nardi AC, Coy-Canguçu A, Saito A, Florio MF, Marti G, Degasperi GR, Orsi FA. Immunothrombosis and its underlying biological mechanisms. Hematol Transfus Cell Ther. 2024 Jan-Mar;46(1):49-57. doi: 10.1016/j.htct.2023.05.008. Epub 2023 Jul 1. PMID: 37451977; PMCID: PMC10935458. https://pmc.ncbi.nlm.nih.gov/articles/PMC10935458/
Almskog LM, Ågren A. Thromboinflammation vs. immunothrombosis: strategies for overcoming anticoagulant resistance in COVID-19 and other hyperinflammatory diseases. Is ROTEM helpful or not? Front Immunol. 2025 Jun 19;16:1599639. doi: 10.3389/fimmu.2025.1599639. PMID: 40612950; PMCID: PMC12221889. https://pmc.ncbi.nlm.nih.gov/articles/PMC12221889/
Antoniak S, Owens AP 3rd, Baunacke M, Williams JC, Lee RD, Weithäuser A, Sheridan PA, Malz R, Luyendyk JP, Esserman DA, Trejo J, Kirchhofer D, Blaxall BC, Pawlinski R, Beck MA, Rauch U, Mackman N. PAR-1 contributes to the innate immune response during viral infection. J Clin Invest. 2013 Mar;123(3):1310-22. doi: 10.1172/JCI66125. Epub 2013 Feb 8. PMID: 23391721; PMCID: PMC3582138. https://pmc.ncbi.nlm.nih.gov/articles/PMC3582138/
Raadsen M, Du Toit J, Langerak T, van Bussel B, van Gorp E, Goeijenbier M. Thrombocytopenia in Virus Infections. J Clin Med. 2021 Feb 20;10(4):877. doi: 10.3390/jcm10040877. PMID: 33672766; PMCID: PMC7924611. https://pubmed.ncbi.nlm.nih.gov/33672766/
Press releases – The influenza virus and its influence on blood stem cells and coagulation – Paul-Ehrlich-Institut. (n.d.). https://www.pei.de/EN/newsroom/press-releases/year/2022/17-influenza-virus-influence-blood-stem-cells-coagulation.html
Yamamoto Y, Ohara Y, Iwai A, Hara R, Matsuki T, Fukushima K, Oshitani Y, Kagawa H, Tsujino K, Yoshimura K, Miki M, Miki K, Mori M, Kida H. Influenza Vaccination-associated Acute Thrombocytopenia and Diffuse Alveolar Hemorrhage. Intern Med. 2020 Jul 1;59(13):1633-1637. doi: 10.2169/internalmedicine.3991-19. Epub 2020 Mar 19. PMID: 32188805; PMCID: PMC7402960. https://pmc.ncbi.nlm.nih.gov/articles/PMC7402960
Almohammadi A, Lundin MS, Abro C, Hrinczenko B. Epistaxis and gross haematuria with severe thrombocytopaenia associated with influenza vaccination. BMJ Case Rep. 2019 May 6;12(5):e229423. doi: 10.1136/bcr-2019-229423. PMID: 31061198; PMCID: PMC6510128. v https://pmc.ncbi.nlm.nih.gov/articles/PMC6510128/
Yamamoto Y, Ohara Y, Iwai A, Hara R, Matsuki T, Fukushima K, Oshitani Y, Kagawa H, Tsujino K, Yoshimura K, Miki M, Miki K, Mori M, Kida H. Influenza Vaccination-associated Acute Thrombocytopenia and Diffuse Alveolar Hemorrhage. Intern Med. 2020 Jul 1;59(13):1633-1637. doi: 10.2169/internalmedicine.3991-19. Epub 2020 Mar 19. PMID: 32188805; PMCID: PMC7402960. https://pubmed.ncbi.nlm.nih.gov/32188805/
Hamiel U, Kventsel I, Youngster I. Recurrent Immune Thrombocytopenia After Influenza Vaccination: A Case Report. Pediatrics. 2016 Dec;138(6):e20160124. doi: 10.1542/peds.2016-0124. Epub 2016 Nov 8. PMID: 27940665. https://pubmed.ncbi.nlm.nih.gov/27940665/
Owatanapanich S, Wanlapakorn N, Tangsiri R, Poovorawan Y. Measles-mumps-rubella vaccination induced thrombocytopenia: a case report and review of the literature. Southeast Asian J Trop Med Public Health. 2014 Sep;45(5):1053-7. PMID: 25417506. https://pubmed.ncbi.nlm.nih.gov/25417506/
Kashyape SS, Kashyape PS. Thrombocytopenia following MMR vaccination. Indian Pediatr. 2005 Jan;42(1):80-2. PMID: 15695871. https://pubmed.ncbi.nlm.nih.gov/15695871/
Mortelmans LJ, Gert C, Guido JY. Thrombocytopenia after tetanus vaccination. Eur J Emerg Med. 2009 Dec;16(6):345-6. doi: 10.1097/MEJ.0b013e328321b7a4. PMID: 19904082. https://pubmed.ncbi.nlm.nih.gov/19904082/
Huang AA, Moore GE, Scott-Moncrieff JC. Idiopathic immune-mediated thrombocytopenia and recent vaccination in dogs. J Vet Intern Med. 2012 Jan-Feb;26(1):142-8. doi: 10.1111/j.1939-1676.2011.00850.x. Epub 2011 Dec 13. PMID: 22151468. https://pubmed.ncbi.nlm.nih.gov/22151468/
Woo EJ, Wise RP, Menschik D, Shadomy SV, Iskander J, Beeler J, Varricchio F, Ball R. Thrombocytopenia after vaccination: case reports to the US Vaccine Adverse Event Reporting System, 1990-2008. Vaccine. 2011 Feb 1;29(6):1319-23. doi: 10.1016/j.vaccine.2010.11.051. Epub 2010 Nov 30. PMID: 21126606. https://pubmed.ncbi.nlm.nih.gov/21126606/
Wang JJ, Schönborn L, Warkentin TE, Müller L, Thiele T, Ulm L, Völker U, Ameling S, Franzenburg S, Kaderali L, Tzvetkova A, Colella A, Chataway T, Tan CW, Armour B, Troelnikov A, Rutten L, McCluskey J, Zahn R, Gordon TP, Greinacher A. Adenoviral Inciting Antigen and Somatic Hypermutation in VITT. N Engl J Med. 2026 Feb 12;394(7):669-683. doi: 10.1056/NEJMoa2514824. PMID: 41671482; PMCID: PMC12900036. https://pubmed.ncbi.nlm.nih.gov/41671482/
Vitriol, D. V. (2024, September 3). Meine Highlights aus den Protokollen des Kanzleramtes. DrBine’s Newsletter.
Vitriol, D. V. (2024b, September 26). Was Johnson&Johnson wusste Teil 2. DrBine’s Newsletter.
Warkentin TE, Baskin-Miller J, Raybould AL, Sheppard JI, Daka M, Nazy I, Moll S. Adenovirus-Associated Thrombocytopenia, Thrombosis, and VITT-like Antibodies. N Engl J Med. 2023 Aug 10;389(6):574-577. doi: 10.1056/NEJMc2307721. PMID: 37590457. https://pubmed.ncbi.nlm.nih.gov/37590457/
Schönborn L, Esteban O, Wesche J, Dobosz P, Broto M, Puig SR, Fuhrmann J, Torres R, Serra J, Llevadot R, Palicio M, Wang JJ, Gordon TP, Lindhoff-Last E, Hoffmann T, Alberio L, Langer F, Boehme C, Biguzzi E, Grosse L, Endres M, Liman T, Thiele T, Warkentin TE, Greinacher A. Anti-PF4 immunothrombosis without proximate heparin or adenovirus vector vaccine exposure. Blood. 2023 Dec 28;142(26):2305-2314. doi: 10.1182/blood.2023022136. PMID: 37883798; PMCID: PMC10862238. https://pubmed.ncbi.nlm.nih.gov/37883798/
Campello E, Biolo M, Simioni P. More on Adenovirus-Associated Thrombocytopenia, Thrombosis, and VITT-like Antibodies. N Engl J Med. 2023 Nov 2;389(18):1729. doi: 10.1056/NEJMc2310644. PMID: 37913522. https://pubmed.ncbi.nlm.nih.gov/37913522/
Tarassishin L, Szawlowski P, McLay J, Kidd AH, Russell WC. Adenovirus core protein VII displays a linear epitope conserved in a range of human adenoviruses. J Gen Virol. 1999 Jan;80 ( Pt 1):47-50. doi: 10.1099/0022-1317-80-1-47. PMID: 9934682. https://pubmed.ncbi.nlm.nih.gov/9934682/
Greber UF, Flatt JW. Adenovirus Entry: From Infection to Immunity. Annu Rev Virol. 2019 Sep 29;6(1):177-197. doi: 10.1146/annurev-virology-092818-015550. Epub 2019 Jul 5. PMID: 31283442. https://pubmed.ncbi.nlm.nih.gov/31283442/
Greber UF, Flatt JW. Adenovirus Entry: From Infection to Immunity. Annu Rev Virol. 2019 Sep 29;6(1):177-197. doi: 10.1146/annurev-virology-092818-015550. Epub 2019 Jul 5. PMID: 31283442. https://pubmed.ncbi.nlm.nih.gov/31283442/